
反应原料:电石(主要成分CaC2、含有杂质CaS、Ca3P2等)、饱和食盐水
实验原理:主反应 CaC2+2H2O→C2H2↑+Ca(OH)2 (不需要加热)
副反应: CaS+2H2O=Ca(OH)2+H2S↑
Ca3P2+6H2O=3Ca(OH)2+2PH3↑
制气类型:“固+液气”型(如图1) [圆底烧瓶、分液漏斗、导气管、试管、水槽]
实验装置:
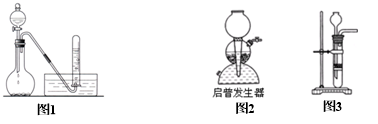
净化装置:通过盛有NaOH溶液或CuSO4溶液的洗气瓶除去H2S、PH3等杂质
收集装置:排水法

①实验室制取乙炔时,不能用排空气法收集乙炔:乙炔的相对分子质量为26,空气的平均相对分子质量为29,二者密度相差不大,难以收集到纯净的乙炔。
②电石与水反应剧烈,为得到平稳的乙炔气流,可用饱和氯化钠溶液代替水,并用分液漏斗控制滴加饱和氯化钠溶液的速率,让饱和氯化钠溶液慢慢地滴入。
③CaC2和水反应剧烈并产生泡沫,为防止产生的泡沫涌入导管,应在导管口塞入少许棉花 (图示装置中未画出)。
④生成的乙炔有臭味的原因:由于电石中含有可以与水发生反应的杂质(如CaS、Ca3P2等),使制得的乙炔中往往含有H2S、PH3等杂质,将混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去
⑤制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是
a.碳化钙吸水性强,与水反应剧烈,不能随用、随停;
b.反应过程中放出大量的热,易使启普发生器炸裂;
c.反应后生成的石灰乳是糊状,堵住球形漏斗和底部容器之间的空隙,使启普发生器失去作用;
⑥盛电石的试剂瓶要及时密封并放于干燥处,严防电石吸水而失效。取电石要用镊子夹取,切忌用手拿。