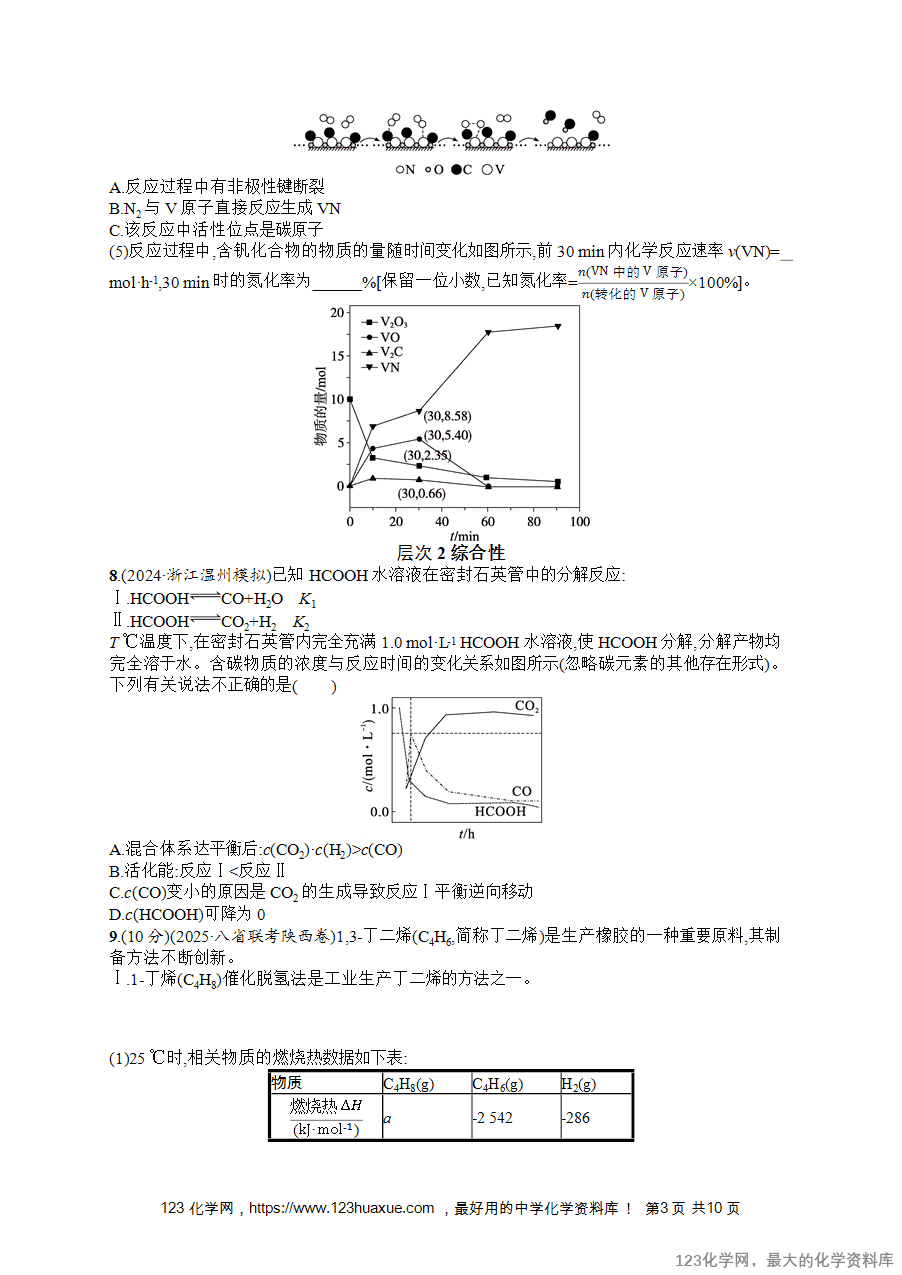
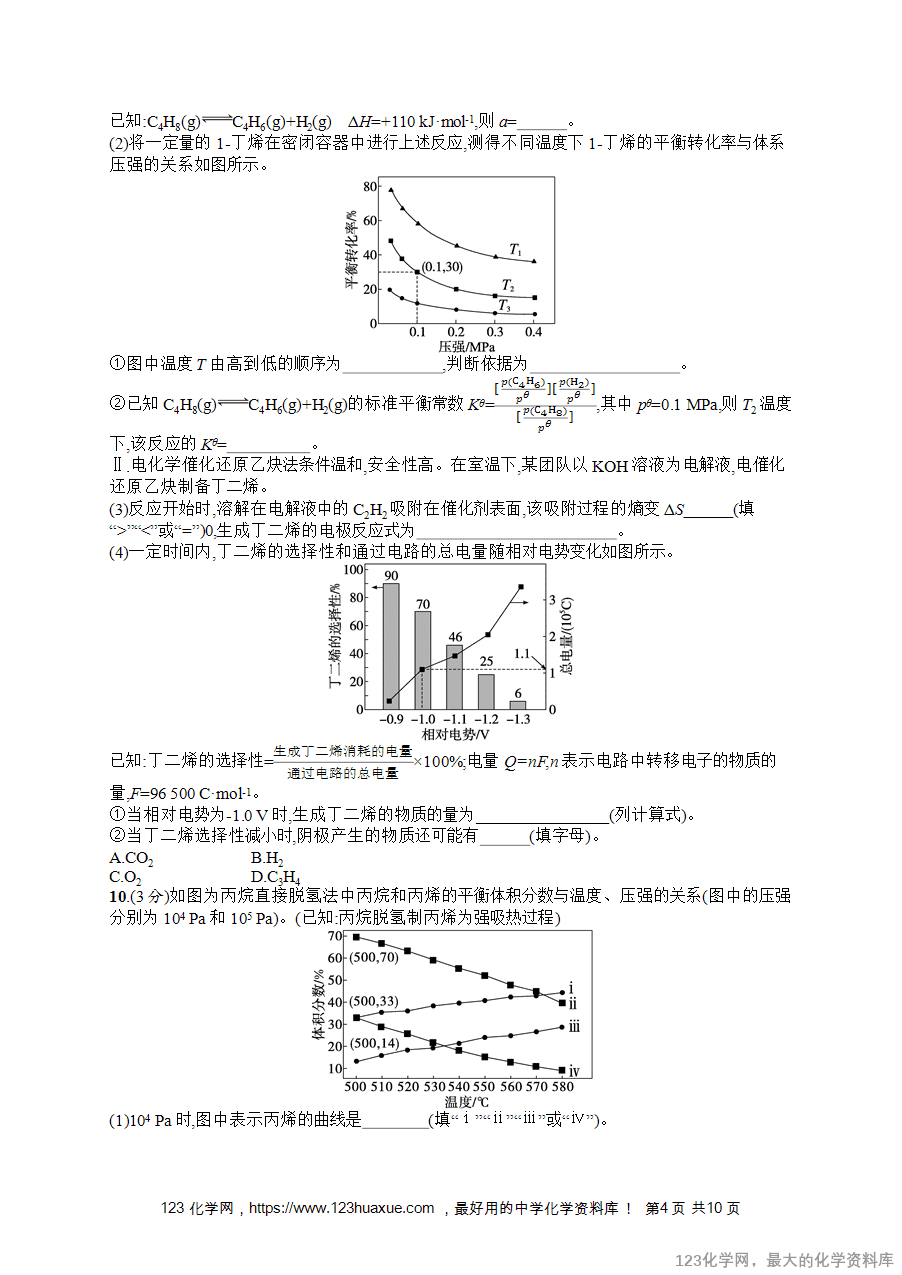
层次1基础性
1.利用CO2和CH4反应制备合成气(CO、H2)的原理是CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH>0。温度为T ℃时,该反应的平衡常数为K。下列说法正确的是( )
A.K越大,说明反应速率、CO2的平衡转化率越大
B.增大压强,平衡向逆反应方向移动,K减小
C.升高温度,反应速率和平衡常数K都增大
D.加入催化剂,能提高合成气的平衡产率
2.常压下羰基化法精炼镍的原理为Ni(s)+4CO(g)Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
A.第一阶段应选择稍高于42.2 ℃的反应温度
B.该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
C.其他条件不变,增加c(CO),平衡正向移动,平衡常数增大
D.第二阶段,230 ℃时,反应的平衡常数很小,故Ni的产率很低
3.25 ℃时,向40 mL 0.05 mol·L-1的FeCl3溶液中一次性加入10 mL 0.15 mol·L-1的KSCN溶液,发生反应,混合溶液中c(Fe3+)随反应时间(t)的变化如图所示。下列说法正确的是( )