











第22讲 化学平衡的移动
练习1 化学平衡的移动
1. (2024·如东、前黄、姜堰三校)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ. CO2(g)+3H2(g)CH3OH (g)+H2O(g) ΔH1=-49.5 kJ/mol
Ⅱ. CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+43.9 kJ/mol
在密闭容器中,压强恒为1.0×106 Pa,n起始(CO2)=1 mol,n起始(H2)=4 mol,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率,随温度的变化如图所示。
CH3OH的选择性可表示为()()n反应CO2(n生成CH3OHCO2)×100%。
(1) 反应的最佳温度为350~400 ℃。
(2) 反应温度超过550 ℃时,CO2平衡转化率逐渐增大的原因是温度超过550 ℃时,反应Ⅱ的正向移动幅度比反应Ⅰ的逆向移动幅度大。
(3) 反应温度超过550 ℃时,CO2实际转化率逐渐减小的原因是温度升高使催化剂的活性不断降低。
(4) 反应温度在550 ℃时,X点CH3OH的选择性为50%,则平衡时p(H2O)=1.36×105Pa(保留三位有效数字,后面相同),反应Ⅱ的压强平衡常数Kp=0.161。
【解析】 (1) 由图可知,400 ℃时CO2实际转化率最大,用该催化剂催化CO2反应的最佳温度范围约为350~400 ℃。(2) 反应Ⅰ是放热反应,升高温度,平衡逆向移动,CO2平衡转化率减小;反应Ⅱ是吸热反应,升高温度,平衡正向移动,CO2平衡转化率增大,反应温度超过550 ℃时,CO2平衡转化率逐渐增大的原因是温度超过550 ℃时,反应Ⅱ的正向移动幅度比反应Ⅰ的逆向移动幅度大。(3) 550 ℃以后,CO2平衡转化率随温度升高而增大,表明温度升高对平衡Ⅱ的影响占主导地位,CO2实际转化率随温度升高而降低,原因是温度升高使催化剂的活性不断降低。(4) 550 ℃时CO2转化率为60%,消耗的CO2为0.6 mol,CH3OH的选择性为50%,可知生成CH3OH的CO2为0.3 mol,则反应Ⅰ消耗的CO2和H2分别为0.3 mol、0.9 mol,生成的CH3OH和水分别为0.3 mol、0.3 mol;反应Ⅱ消耗的CO2和H2分别为0.3 mol、0.3 mol,生成的CO和H2O分别为0.3 mol、0.3 mol;平衡时体系中CO2、H2、CH3OH、CO、H2O分别为0.4 mol、2.8 mol、0.3 mol、0.3 mol、0.6 mol,总计为4.4 mol,平衡时p(H2O)=4.4 mol(0.6 mol)×1.0×106 Pa≈1.36×105 Pa,反应Ⅱ的压强平衡常数Kp=×1.0×106 Pa(2.8)≈0.161。
2. (2024·苏州、海门、淮阴、姜堰中学四校)石油化工、煤化工等行业的废气中均含有硫化氢,需要将其回收处理并利用。
(1) 热分解法:2H2S(g)2H2(g)+S2(g) ΔH=+170 kJ/mol。工业上,通常在等温、等压条件下将H2S与Ar的混合气体通入反应器,发生H2S热分解反应,达到平衡状态后,若继续向反应器中通入Ar,H2S的平衡转化率会增大(填“增大”“减小”或“不变”)。
(2) 氧化法:2H2S(g)+O2(g)S2(g)+2H2O(g)
已知:2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH=-1 036 kJ/mol
4H2S(g)+2SO2(g)===3S2(g)+4H2O(g) ΔH=+94 kJ/mol
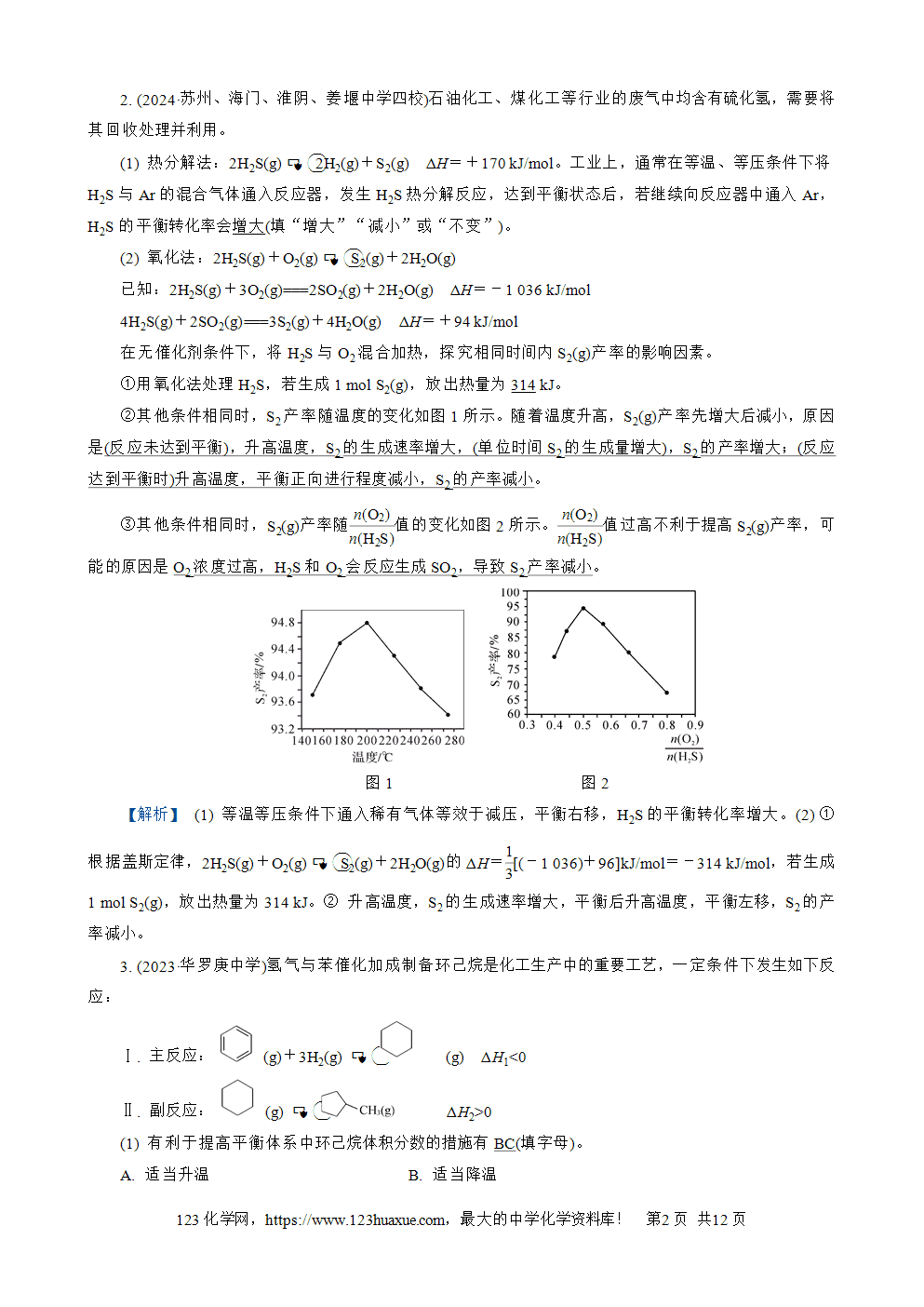
在无催化剂条件下,将H2S与O2混合加热,探究相同时间内S2(g)产率的影响因素。
①用氧化法处理H2S,若生成1 mol S2(g),放出热量为314 kJ。
②其他条件相同时,S2产率随温度的变化如图1所示。随着温度升高,S2(g)产率先增大后减小,原因是(反应未达到平衡),升高温度,S2的生成速率增大,(单位时间S2的生成量增大),S2的产率增大;(反应达到平衡时)升高温度,平衡正向进行程度减小,S2的产率减小。
③其他条件相同时,S2(g)产率随()()nH2S(nO2)值的变化如图2所示。()()nH2S(nO2)值过高不利于提高S2(g)产率,可能的原因是O2浓度过高,H2S和O2会反应生成SO2,导致S2产率减小。
图1 图2
【解析】 (1) 等温等压条件下通入稀有气体等效于减压,平衡右移,H2S的平衡转化率增大。(2) ① 根据盖斯定律,2H2S(g)+O2(g)S2(g)+2H2O(g)的ΔH=3(1)[(-1 036)+96]kJ/mol=-314 kJ/mol,若生成1 mol S2(g),放出热量为314 kJ。② 升高温度,S2的生成速率增大,平衡后升高温度,平衡左移,S2的产率减小。