



高考特训15 化学反应速率与化学平衡综合
1. 某温度下,在一恒容密闭容器中进行如下两个反应并达到平衡状态:
①2X(g)+Y(g)Z(s)+2Q(g) ΔH1<0;
②M(g)+N(g)R(g)+Q(g) ΔH2>0。
下列叙述错误的是(B)
A. 加入适量Z,①②平衡均不移动
B. 通入稀有气体Ar,①平衡正向移动
C. 降温时无法判断Q浓度的增减
D. 通入Y,N的浓度增大
【解析】 Z是固体,对平衡移动无影响,A正确;恒容通入Ar,参与反应的各物质浓度不变,平衡不移动,B错误;反应①是放热反应,反应②是吸热反应,降低温度,两个反应的移动方向不同,反应物的起始浓度未知,无法判断Q的浓度增减,C正确;通入Y,反应①正向移动,Q的浓度增大,导致反应②逆向移动,则N的浓度增大,D正确。
2. (2024·泰州一模)二甲醚和水蒸气制氢气可作为燃料电池的氢能源,发生的主要反应如下:
反应Ⅰ. CH3OCH3(g)+H2O(g)===2CH3OH(g)
ΔH1>0
反应Ⅱ. CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH2>0
反应Ⅲ. CO2(g)+H2(g)===CO(g)+H2O(g)
ΔH3>0
在恒压下,将一定比例的二甲醚和水蒸气混合后,以一定流速通过装有催化剂的反应器,反应相同时间测得的CH3OCH3实际转化率、CO2实际选择性与CO2平衡选择性随温度的变化如图所示。CO2的选择性=()()2n反应CH3OCH3(n生成CO2)×100%。下列说法不正确的是(D)
A. 曲线a表示CH3OCH3实际转化率随温度的变化
B. 200 ℃时,反应Ⅱ的速率大于反应Ⅲ的速率
C. 适当增加()()n起始CH3OCH3(n起始H2O),有利于提高H2的产率
D. 一定温度下,若增大压强,CO的平衡产量不变
【解析】 CO2实际选择性与CO2平衡选择性随温度的变化的走势变化应该相同,故曲线b为CO2实际选择性,则曲线a为CH3OCH3实际转化率,A正确;在200 ℃时,CO2实际选择性大于平衡选择性,可知此温度下,反应Ⅱ的速率大于反应Ⅲ,B正确;适当增加()()n起始CH3OCH3(n起始H2O),CH3OCH3的转化率增大,促进反应Ⅱ平衡正向进行、反应Ⅲ平衡逆向进行,从而提高氢气的产率,C正确;增大压强会导致反应Ⅱ平衡逆向移动,从而导致反应Ⅲ平衡逆向移动,CO的平衡产量会减小,D错误。
3. (2024·苏锡常镇一模)采用热分解法脱除沼气中的H2S过程中涉及的主要反应如下:
反应Ⅰ. 2H2S(g)2H2(g)+S2(g)
ΔH1=+169.8 kJ/mol
反应Ⅱ. CH4(g)+S2(g)CS2(g)+2H2(g)
ΔH2=+63.7 kJ/mol
保持100 kPa不变,将H2S与CH4按2∶1体积比投料,并用N2稀释,在不同温度下反应达到平衡时,所得H2、S2与CS2的体积分数如图所示。下列说法正确的是(C)
A. 反应2H2S(g)+CH4(g)CS2(g)+4H2(g)的ΔH=+106.1 kJ/mol
B. 曲线Y代表的是CS2的平衡体积分数
C. 高于1 050 ℃时,H2S平衡转化率与CH4平衡转化率的差值随温度升高减小
D. 1 050 ℃下反应,增大体系的压强,平衡后H2的体积分数可能达到0.07
【解析】 根据盖斯定律,反应Ⅰ+反应Ⅱ可得:2H2S(g)+CH4(g)CS2(g)+4H2(g) ΔH=+233.5 kJ/mol,A错误;升高温度,反应Ⅰ、Ⅱ平衡均正向移动,H2和CS2体积分数增大,根据数量关系,曲线Z代表H2,曲线X代表CS2,S2是反应Ⅰ的生成物同时又是反应Ⅱ的反应物,因此曲线Y代表S2,B错误;1 050~1 150 ℃之间,S2与CS2的体积分数差值越来越小,所以H2S平衡转化率与CH4平衡转化率的差值随温度升高减小,C正确;1 050 ℃下反应,反应Ⅰ和反应Ⅱ都是气体体积增大的反应,增大体系的压强,平衡会逆向移动,平衡后H2的体积分数小于0.07,D错误。
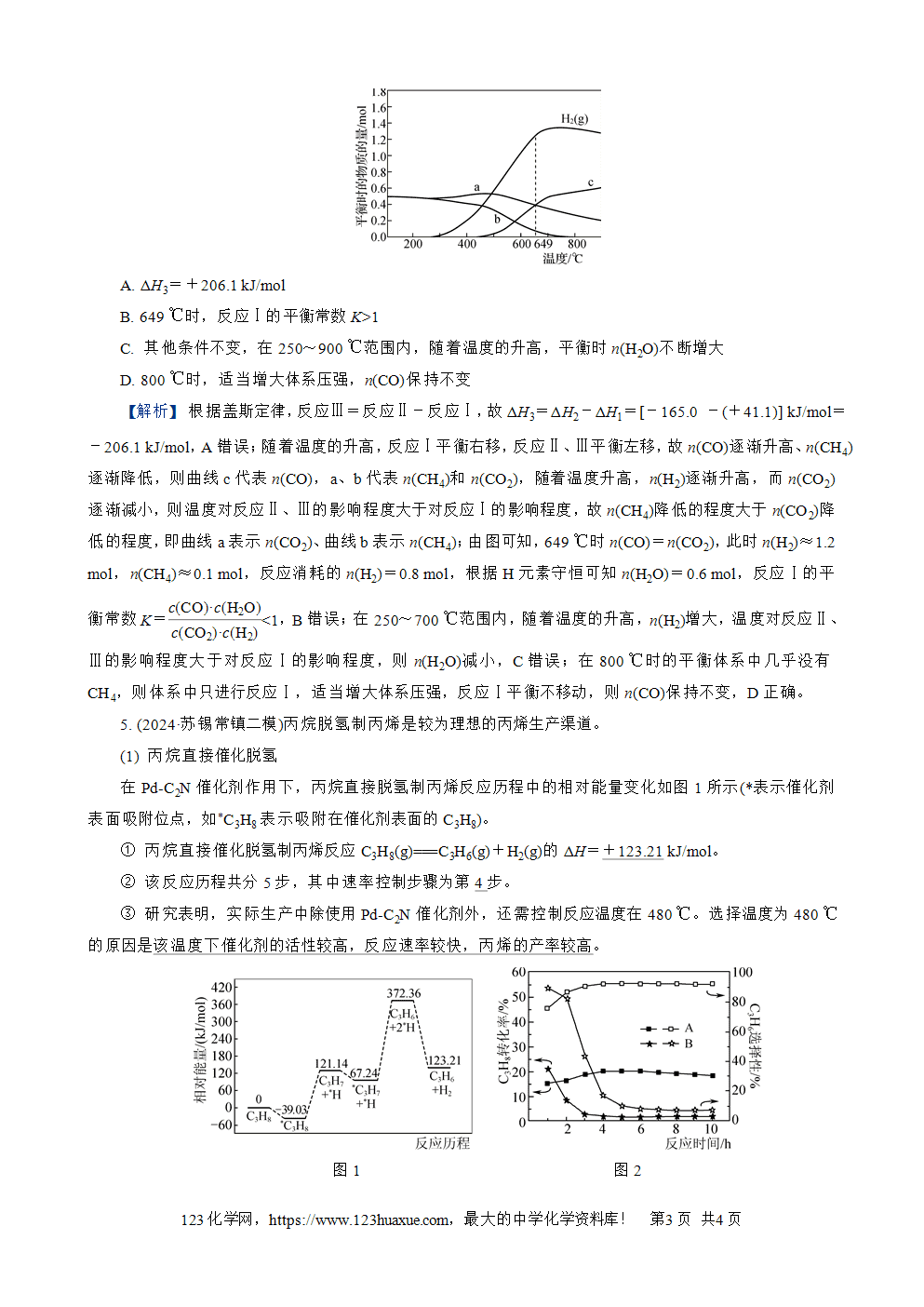
4. (2024·南通二模)逆水煤气变换反应是一种CO2转化和利用的重要途径,发生的反应有
反应Ⅰ. H2(g)+CO2(g)===CO(g)+H2O(g)ΔH1=+41.1 kJ/mol
反应Ⅱ. 4H2(g)+CO2(g)===CH4(g)+2H2O(g)ΔH2=-165.0 kJ/mol
反应Ⅲ. 3H2(g)+CO(g)===CH4(g)+H2O(g)ΔH3
常压下,向密闭容器中投入1 mol CO2和2 mol H2,达到平衡时H2和含碳物质的物质的量随温度的变化如图所示。下列说法正确的是(D)
A. ΔH3=+206.1 kJ/mol
B. 649 ℃时,反应Ⅰ的平衡常数K>1
C. 其他条件不变,在250~900 ℃范围内,随着温度的升高,平衡时n(H2O)不断增大
D. 800 ℃时,适当增大体系压强,n(CO)保持不变
【解析】 根据盖斯定律,反应Ⅲ=反应Ⅱ-反应Ⅰ,故ΔH3=ΔH2-ΔH1=[-165.0 -(+41.1)] kJ/mol=-206.1 kJ/mol,A错误;随着温度的升高,反应Ⅰ平衡右移,反应Ⅱ、Ⅲ平衡左移,故n(CO)逐渐升高、n(CH4)逐渐降低,则曲线c代表n(CO),a、b代表n(CH4)和n(CO2),随着温度升高,n(H2)逐渐升高,而n(CO2)逐渐减小,则温度对反应Ⅱ、Ⅲ的影响程度大于对反应Ⅰ的影响程度,故n(CH4)降低的程度大于n(CO2)降低的程度,即曲线a表示n(CO2)、曲线b表示n(CH4);由图可知,649 ℃时n(CO)=n(CO2),此时n(H2)≈1.2 mol,n(CH4)≈0.1 mol,反应消耗的n(H2)=0.8 mol,根据H元素守恒可知n(H2O)=0.6 mol,反应Ⅰ的平衡常数K=()()()()cCO2·cH2(cCO·cH2O)<1,B错误;在250~700 ℃范围内,随着温度的升高,n(H2)增大,温度对反应Ⅱ、Ⅲ的影响程度大于对反应Ⅰ的影响程度,则n(H2O)减小,C错误;在800 ℃时的平衡体系中几乎没有CH4,则体系中只进行反应Ⅰ,适当增大体系压强,反应Ⅰ平衡不移动,则n(CO)保持不变,D正确。