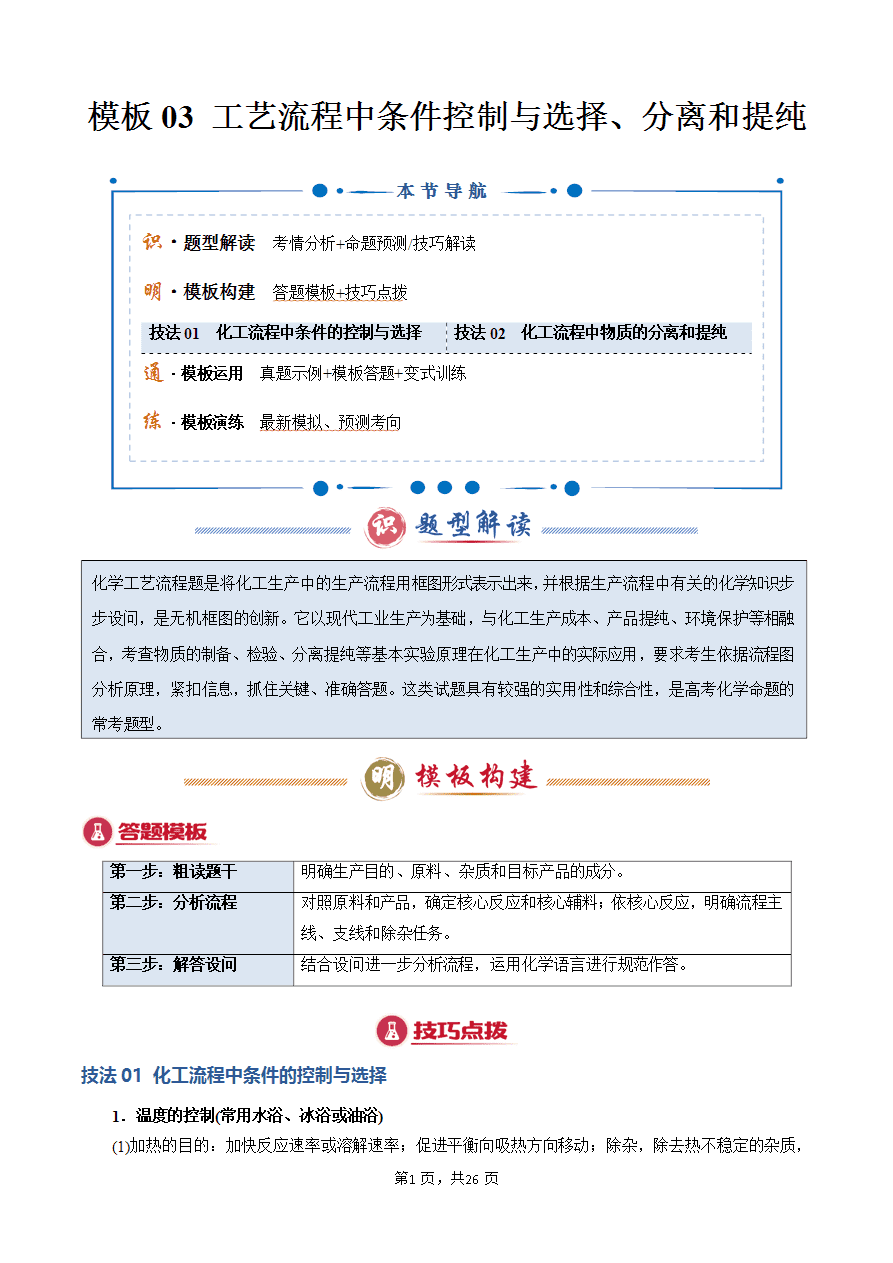
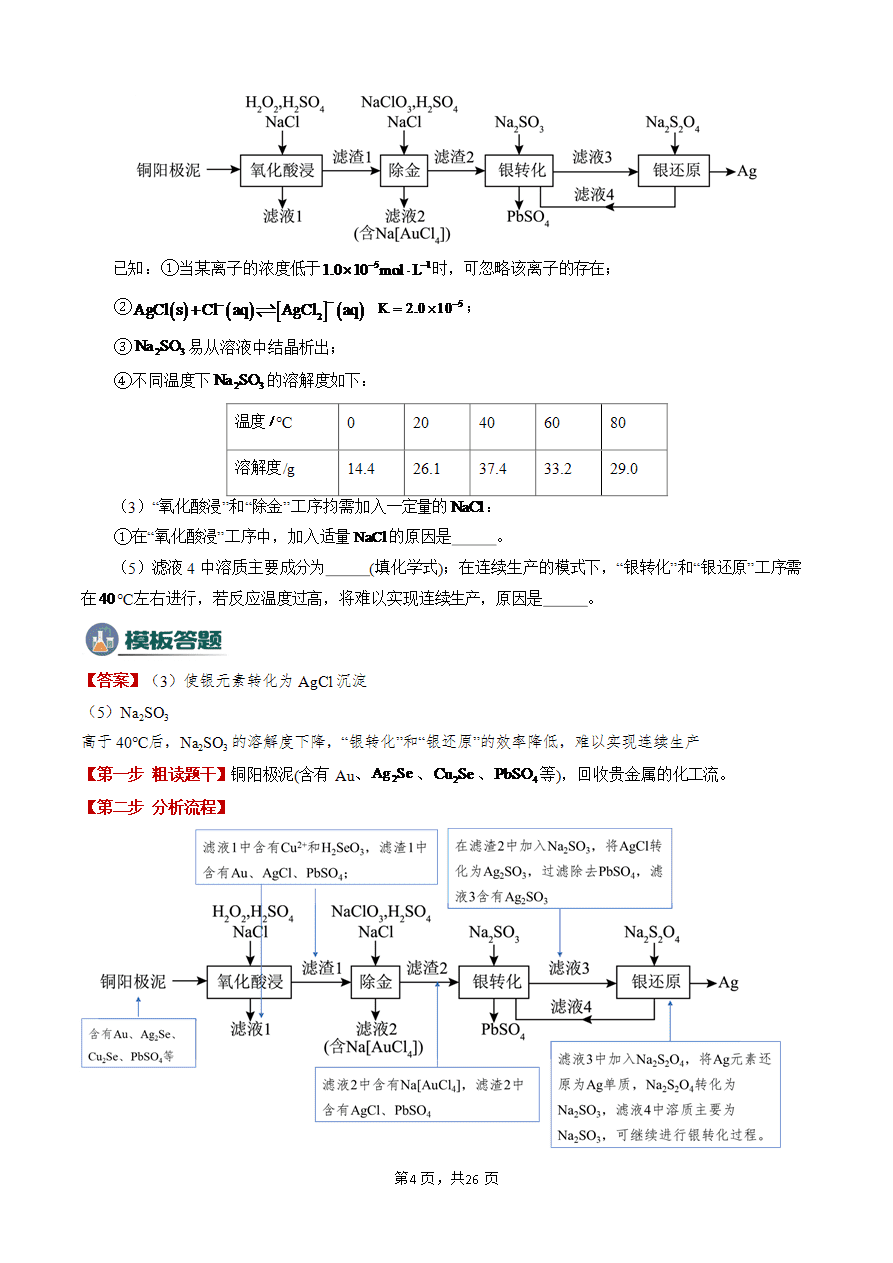
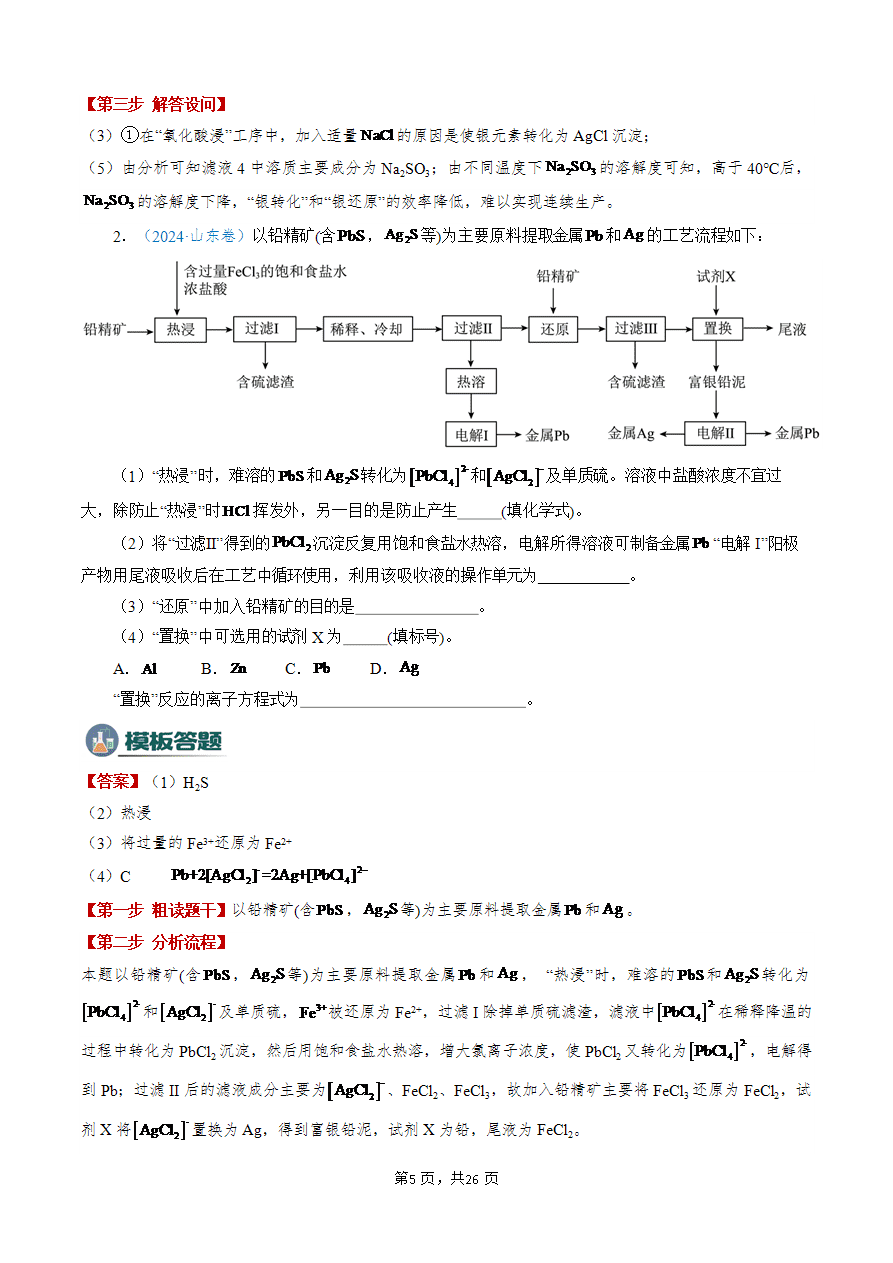
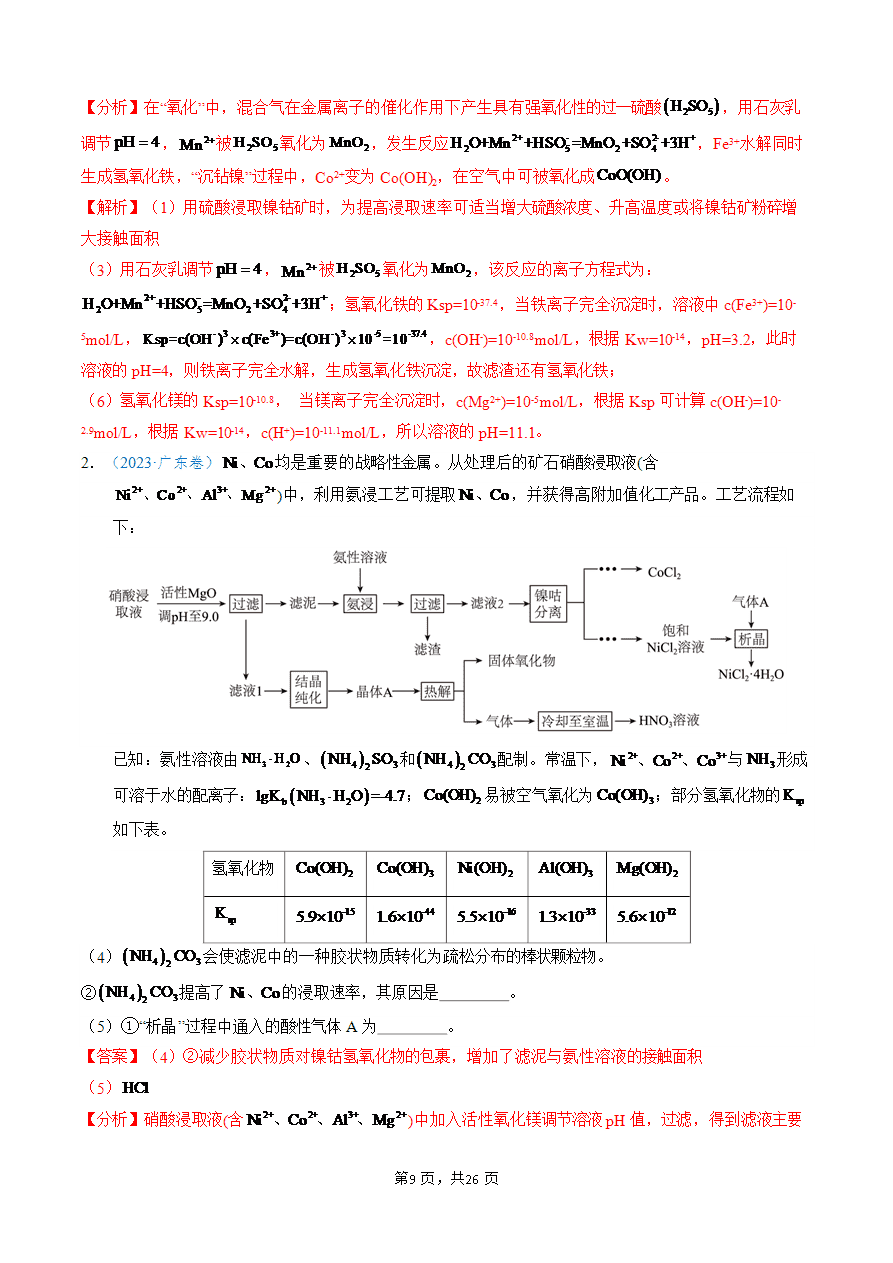
化工流程中条件的控制与选择
1.温度的控制(常用水浴、冰浴或油浴)
(1)加热的目的:加快反应速率或溶解速率;促进平衡向吸热方向移动;除杂,除去热不稳定的杂质,如NaHCO3、Ca(HCO3)2、KMnO4、NH4Cl等物质;使沸点相对较低或易升华的原料汽化。
(2)降温的目的:防止某物质在高温时会溶解(或分解);使化学平衡向着题目要求的方向(放热方向)移动;使某个沸点较高的产物液化,使其与其他物质分离;降低晶体的溶解度,减少损失。
(3)控制温度在一定范围的目的:结晶为获得所需物质(用水浴带温度计便于控温且受热均匀);防止某种物质(如H2O2、草酸、浓硝酸、铵盐等)因温度过高时会分解或挥发;使催化剂的活性达到最高;防止副反应的发生。
(4)降温或减压可以减少能源成本,降低对设备的要求,达到绿色化学的要求。
(5)控制固体的溶解与结晶
趁热过滤:减少因降温而析出的溶质的量。
蒸发浓缩:蒸发除去部分溶剂,提高溶液的浓度。
蒸发结晶:蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出。
从溶液中得到晶体的过程:蒸发浓缩→冷却结晶→过滤→洗涤、干燥。
2.pH的控制
(1)控制一定的pH,以提供反应所需环境。反应环境的不同会导致反应产物的差异。如在酸性环境中KMnO4的还原产物一般为Mn2+,中性(或弱酸性)环境中KMnO4的还原产物一般为MnO2。
(2)控制一定的pH,以改变元素的存在形式。如铝元素在强酸性条件下以Al3+形式存在,当体系的pH增大,铝元素将以Al(OH)3甚至以AlO2(-)或[Al(OH)4]-的形式存在。
(3)控制一定的pH,使金属阳离子形成氢氧化物沉淀。