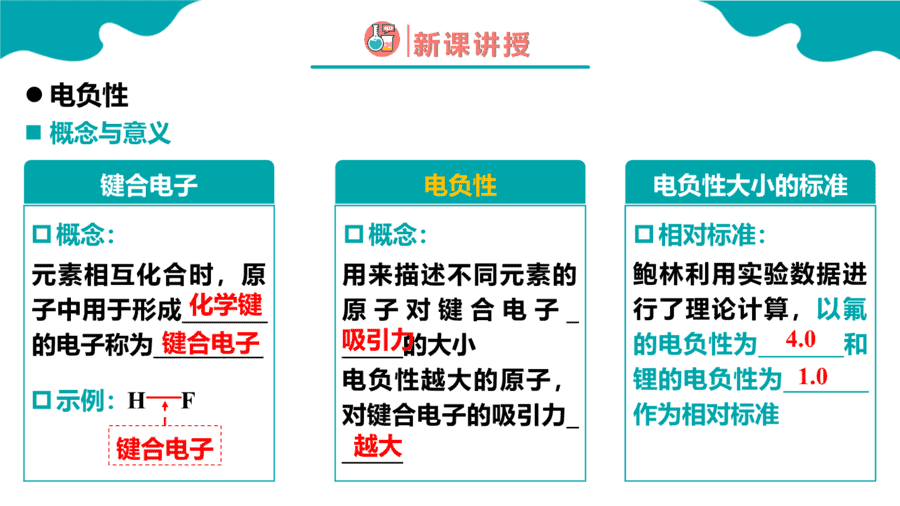
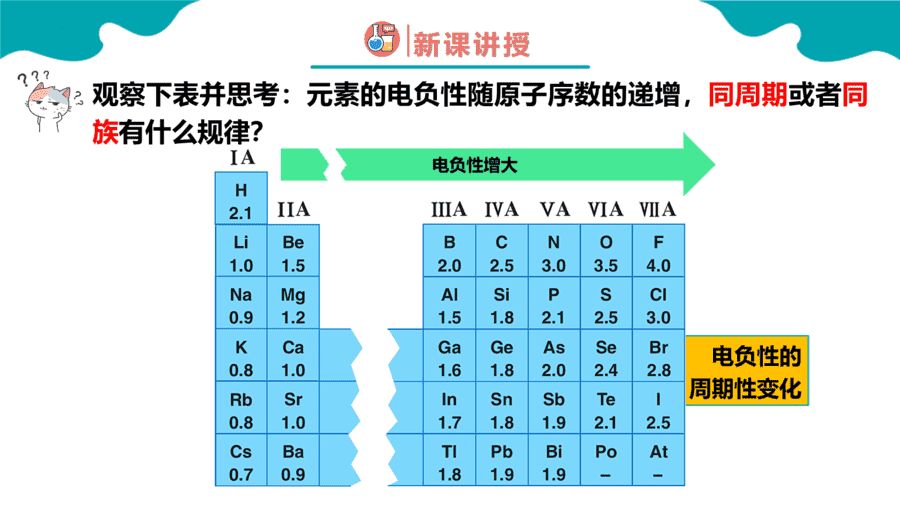
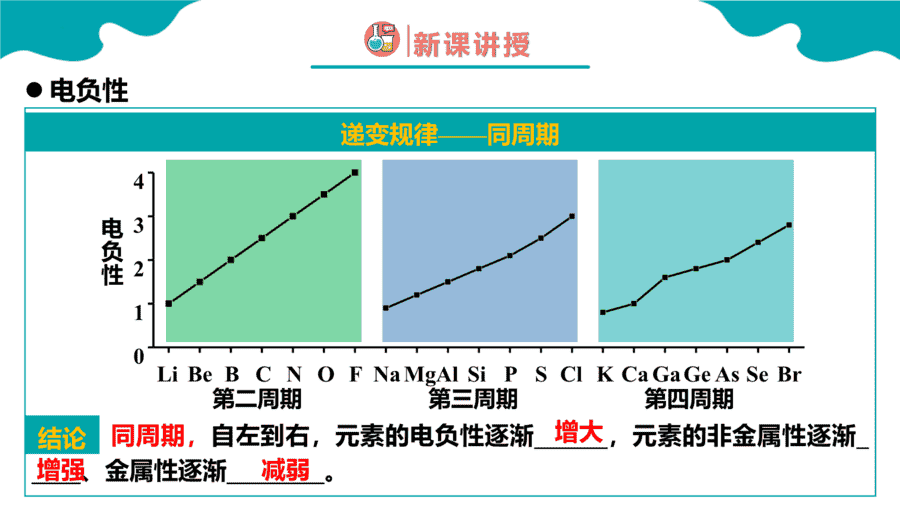
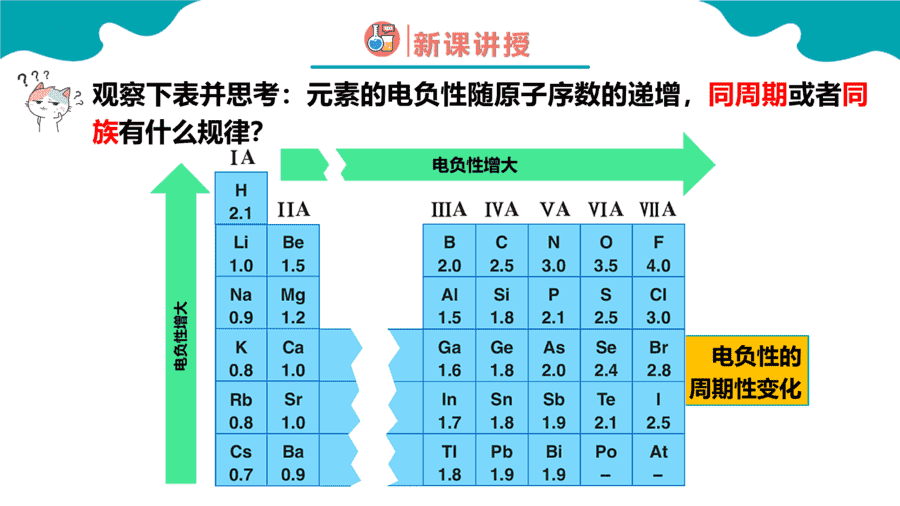
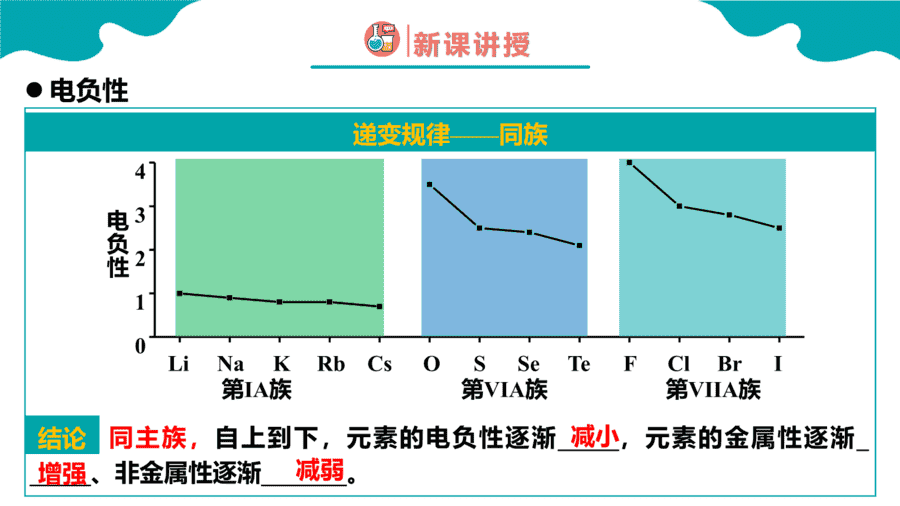
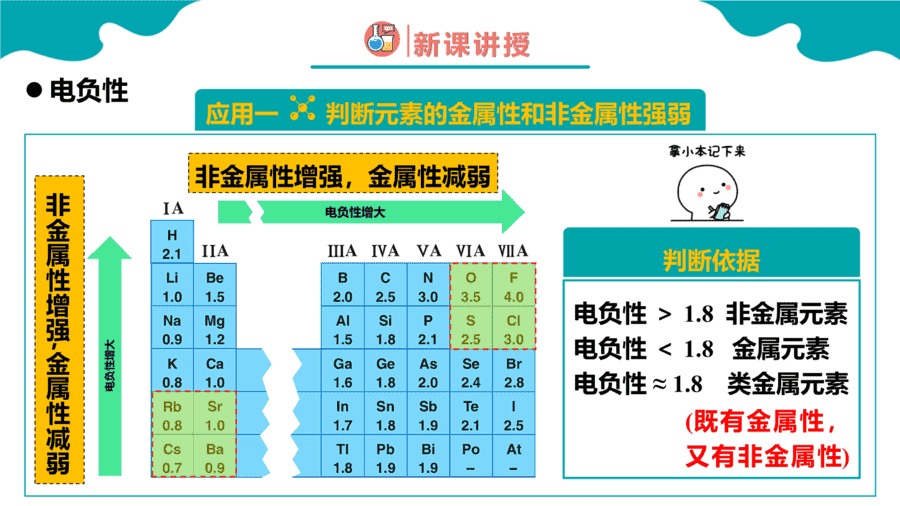
1.元素性质呈现周期性变化的根本原因是
A.元素的电负性呈周期性变化 B.元素的第一电离能呈周期性变化
C.元素原子的核外电子排布呈周期性变化 D.元素的金属性、非金属性呈周期性变化
【答案】C
【详解】
2.(2023上·河北邯郸·高二校联考阶段练习)食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱和小苏打。下列说法正确的是
A.离子半径: B.电负性:
C.非金属性: D.第一电离能:
【答案】D
【详解】A.钠离子和氧离子的核外电子排布相同,氧离子的核电荷数小因此其半径更大,故A错误;
B.同周期元素,核电荷数越大电负性越大,电负性:,故B错误;
C.同周期元素核电荷数越大,非金属性越强,非金属性:,故C错误;
D.同周期元素从左到右第一电离能整体趋势为增大,同主族元素核电荷数越大第一电离能越小,第一电离能:,故D正确;
故选D。
3.离子键的百分数是依据电负性的差值计算出来的,差值越大,离子键的百分数越大,下列几种化合物的化学键中离子键的百分数最大的是
A.LiF B.AlCl3 C.MgO D.SO3
【答案】A
【详解】根据电负性的递变规律,上述化合物中金属元素电负性:Al>Mg>Li,非金属元素的电负性F>O>Cl>S,故上述化合物中电负性差值最大的是LiF,离子键的百分数最大的是LiF,A项符合题意。
答案选A。