高考化学配合物的考点常见有六个。1、判断中心离子化合价。2、确定中心离子的配位数3、计算配离子中σ数目4、推断配位配体分子中的配位原子5、判断中心原子的杂化类型6、书写配合物的结构式等。
解这类题需要明白以下的知识:(1)配合物的中心离子是过渡金属的原子或离子(价电子层的d轨道和S、P轨道是空轨道)(2)配体是含有孤电子对的离子(如Cl-、CN-、NO2-)或分子(CO、NH3、H2O),但不能是“基”或中性原子,如羟基、氨基、氯原子等。“基”与中性原子不是8电子稳定结构,不能独立存在的。3、双原子分子或离子作配体时,电负性小的原子提共孤电子对。([Ni(CN)4]2-离子,提供孤电子对的是电负性小的碳元素)4、形成配位键的孤电对,一般在最外层P轨道上,当然H-离子的S轨道上孤电子对也能形成配位键。
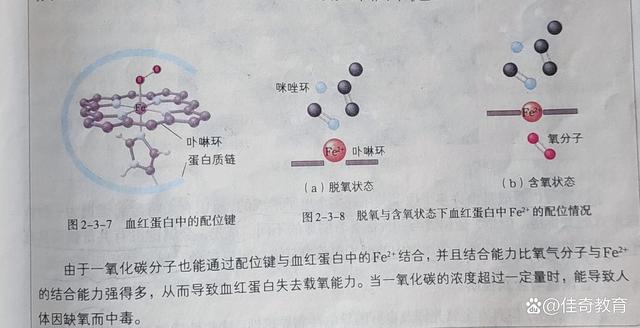
解决配合物问题的关键是确定形成配位键的粒子,即形成配合物(或配离子)之前,配体是什么粒子。如铜氨配离子是由铜离子与氨分子形成的,铵根可看作是氨分子与氢离子结合而成,血红蛋白载氧后,氧分子与Fe2+形成了配位键。
例1:75号元素铼Re,熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。铼(Re)易形成高配位数的化合物如Re2(CO)10,该配合物中__________(填元素符号)提供孤对电子与铼形成配位键,原因是__________1mol中有________mol配位键.
分析:与铼形成配位化合物配体是CO分子,分子中碳与氧皆有孤电子对,都可能形成配位键。但碳元素的电负性小于氧,所以在Re2(CO)10中,与铼原子形成配位键的是碳(C)元素。一个碳提供一个孤电子对,所以1mol中有___10_____mol配位键.
例2、+3价铁的强酸盐溶于水,可逐渐水解产生[Fe2(OH)2(H2O)8]4+结构如下
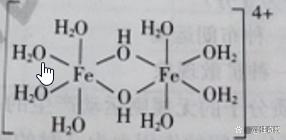
请回答(1)在此离子中Fe的配位数为 (2) 含s、p、d 轨道的杂化类型有 dsp2 、sp3d 、 sp3d2 ,则 [Fe2(OH)(H2O)5]2+中铁的杂化类型为
解析:(1)依据结构式判断配离子的配位数,首先要明白形成配离子的配体粒子是什么。作为配体粒子只能是分子或离子,不能是中性的“基”团或原子。如羟基、氨基等,中性原子团,一般“基”是不能独立稳定存在的,原子中有未成对单电子。
形成[Fe2(OH)2(H2O)8]4+的配体是水分子(H2O)与氢氧根(OH—)。每个铁周围有配体4个水分子,2个氢氧根。所以铁的配位数是2+4=6
(2)由于“杂化轨道只用于形成σ键或者用来容纳未参于成键的孤电子对”(选修三P40,)所以中心原子形成的σ键数(σ电子对数),与杂化形成轨道数相同。每个铁离子形成6个σ键(配位键),有6对共用电子,必须有6个杂化轨道数容纳。sp3d2杂化形成6个杂化轨道,铁的杂化类型为sp3d2。
例3.一种钴的配合物离子结构如图所示,
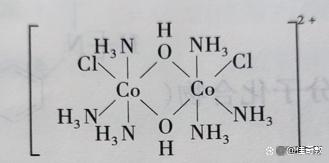
该配合物中钴元素的化合价为 钴的配位数为 解析:此配离子是由氨分子、氯离子(不是氯原子)氢氧根(不是羟基),三种粒子组成。设钴的化合价为X,则2X+2x(-1)+2x(-1)=+2,解之X=3。钴的化合价为+3.钴的配位原子数为6.(2O,3N,1Cl)。