第1节 电离平衡
1.关于强、弱电解质叙述正确的是( C )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱
解析:判断强、弱电解质的关键是看化合物自身是否能在水中全部电离成离子,强电解质在水中完全电离,无溶质分子,弱电解质在水中部分电离,有离子也有溶质分子,从电解质的结构来看,强电解质包括离子化合物和含强极性键的共价化合物,故A错误,C正确;电解质的强弱与电解质的溶解性、导电能力强弱之间没有必然联系,如CaCO3难溶于水,但其溶于水的部分全部电离,故CaCO3为强电解质,B、D错误。
2.在相同温度时,100 mL 0.01 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是( C )
A.中和时所需NaOH的量
B.H+的物质的量浓度
C.H+的物质的量
D.CH3COOH的物质的量
解析:这两种醋酸中的n(CH3COOH)相同,中和NaOH的能力相同,但因为浓度不同,电离程度前者大于后者,所以H+的物质的量前者大,又因为溶液的体积不一样,H+的物质的量浓度前者小。
3.下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | CH3COOH | HNO2 |
电离常数 | 6.2×10-10 | 6.3×10-4 | 1.75×10-5 | 5.6×10-4 |
则0.1 mol·L-1的下列溶液中,c(H+)最大的是( B )
A.HCN B.HF
C.CH3COOH D.HNO2
解析:同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,酸性最强的是HF,最弱的是HCN,c(H+)最大的是酸性最强的,即HF,故选B。
4.用水稀释0.1 mol·L-1的CH3COOH溶液,下列说法正确的是( D )
A.CH3COOH的电离程度增大,溶液中c(H+)增大
B.CH3COOH的Ka逐渐减小
C.溶液中n(H+)减小
D.减小
解析:加水稀释时,醋酸的电离程度增大,n(H+)增大,但溶液稀释导致溶液体积增加的倍数远远超过n(H+)增加的倍数,故溶液中c(H+)变小,A、C项错误;Ka只与温度有关,温度不变,Ka不变,B项错误;由于Ka=,加水稀释时c(H+)变小,Ka不变,增大,则减小,D项正确。
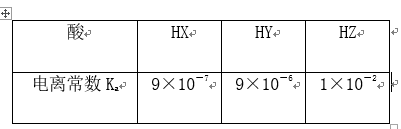
5.相同温度下,根据三种酸的电离常数,下列判断正确的是( B )