第2课时 化学电源
1.碱性电池具有容量大,放电电流大的特点,因而得到广泛的应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO2+2H2O===Zn(OH)2+2MnOOH,下列说法不正确的是( C )
A.电池工作时锌为负极
B.电池正极的电极反应式为2MnO2+2H2O+2e-===2MnOOH+2OH-
C.放电前后电解质溶液的pH保持不变
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
解析:由电池总反应可知,Zn化合价升高,被氧化为原电池的负极,A项正确;由电池总反应知:MnO2在正极上发生还原反应,正极反应式为:2MnO2+2H2O+2e-===2MnOOH+2OH-,B项正确;反应消耗水,溶液的浓度增大,碱性增强,pH增大,C项错误;由电池总反应知,65 g锌反应转移2 mol电子,则外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g,D项正确。
2.据报道,某公司研制了一种由甲醇和氧气,以及强碱作电解质的手机电池,电量可达到镍氢电池的10倍,有关此电池的叙述错误的是( C )
A.溶液中的阳离子移向正极
B.负极反应式:CH3OH+8OH--6e-===CO+6H2O
C.电池在使用过程中,电解质溶液的c(OH-)不变
D.当外电路通过6 mol电子时,理论上消耗1.5mol O2
解析:A项,原电池工作时,溶液中阳离子向正极移动,阴离子向负极移动,正确;B项,燃料电池中,负极是燃料失电子发生氧化反应,反应为CH3OH+8OH--6e-===CO+6H2O,正确;C项,电池总反应是2CH3OH+3O2+4OH-===2CO+6H2O,电池在使用过程中,电解质溶液中c(OH-)减小,错误;D项,消耗1 mol O2可转移4 mol电子,外电路通过6 mol e-时,消耗1.5 mol O2,正确。
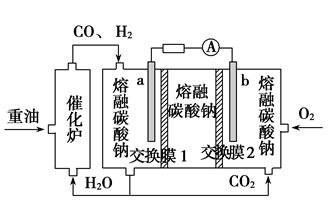
3.“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是