
一、反应热 焓变
(一)反应热及其测定
1、体系与环境
被研究的物质系统称为 体系 ,与体系相互影响的其他部分称为 环境 。
2、反应热
在等温条件下,化学反应体系向环境 释放 或从环境 吸收 的热量,称为化学反应的热效应,简称 反应热 。
3、实验探究:中和反应反应热的测定
(1)测定原理:环境温度不变时,根据测得的体系的 温度 变化和有关物质的 比热容 等来计算反应热。即利用公式: Q=cmΔt 进行计算。
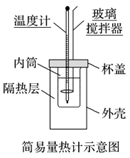
(2)实验装置
①实验装置中各仪器安装如图。
②各部分仪器的作用
玻璃搅拌器的作用是 使反应物混合均匀充分接触 。
隔热层的作用是 减少热量的散失 。
温度计的作用是测定反应前后 反应体系 的温度。
(3)实验步骤
①反应物温度测量(t1):测量混合前50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1氢氧化钠溶液的温度,取两温度平均值 ,记录为起始温度t1。
②反应后体系温度测量(t2):将 酸碱 溶液迅速混合,用 玻璃搅拌器 轻轻搅动溶液,并准确读取混合溶液的最高温度 ,记录为终止温度t2。
③重复实验操作两次,记录每次的实验数据,取其 平均值 作为计算依据。
(4)实验数据处理
设溶液的密度均为1 g·cm-3,中和后溶液的比热容c= 4.18 J·g-1·℃-1 ,根据实验数据计算出该反应放出的热量Q≈ 1.42 kJ,则生成1 mol H2O时放出的热量为 56.8 kJ。
(5)实验结论
大量实验测得,在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液,发生中和反应生成 1 mol H2O时,放出 57.3 kJ 的热量。