
水溶液中的离子反应与平衡
第一节 电离平衡
一、强电解质和弱电解质
1、电解质:在水溶液中或 熔融状态下 能导电的化合物。
2、非电解质:在水溶液中和 熔融状态下 均以分子形式存在,因而不能导电的化合物。
3、强电解质和弱电解质
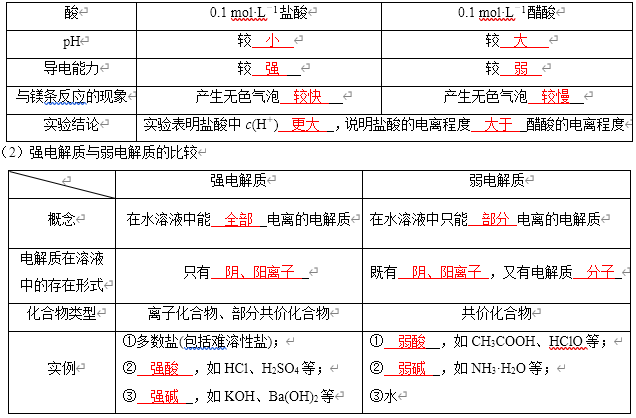
(1)实验探究盐酸和醋酸的电离程度
二、弱电解质的电离平衡
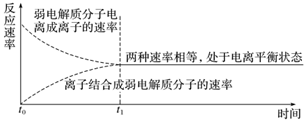
1、电离平衡状态
(1)概念:在一定条件(如温度、浓度)下,弱电解质分子 电离成离子的速率 与 离子结合成弱电解质分子的速率 相等,溶液中各分子和离子的 浓度 都不再发生变化,电离过程就达到了电离平衡状态。
(2)建立过程
2、电离方程式的书写
(1)强电解质:完全电离,在写电离方程式时,用“===”。
(2)弱电解质:部分电离,在写电离方程式时,用“⇄”。
3、电离平衡的影响因素
(1)温度:弱电解质的电离一般是 吸热 过程,升高温度使电离平衡向 电离 的方向移动,电离程度 增大 。
(2)浓度:在一定温度下,同一弱电解质溶液,浓度越小,离子相互碰撞结合为分子的几率 越小 ,电离程度 越大 。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动,电离程度 减小 。
(4)化学反应:加入能与弱电解质电离出的离子发生反应的离子时,电离平衡向 电离 方向移动。
资料标签: