答题模板
实验操作(取少量或适量待检溶液于试管中,加入……试剂,再加入……试剂)
⇓
现象描述(①溶液由……变为……,②若有……生成,③若没有……等)
⇓
得出结论(如“若……说明……,若……说明……”)
典例剖析
(NH4)2SO4是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260 ℃和400 ℃时分解产物不同。
【实验探究】该小组拟选用下图所示装置进行实验(夹持和加热装置略)。
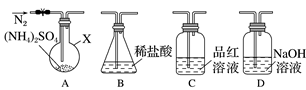
连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400 ℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO,无SO。进一步研究发现,气体产物中无氮氧化物。
检验装置D内溶液中有SO,无SO的实验操作和现象是____________________________。
解题思路 (1)明确原理:依据题目要求,明确检验的原理,根据原理确定方法。如SO、SO都与Ba2+产生沉淀,但BaSO3可溶于盐酸而BaSO4不溶于盐酸。
(2)叙述操作:取液体(水层少量液体)、加试剂(如加BaCl2溶液、加盐酸酸化等)。
(3)描述现象:观察产生沉淀及沉淀如何变化要明确具体。
(4)得出结论:由什么现象得出对应结论,如“若……说明……,若……说明……”。
答案 取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀,加入足量稀盐酸后,沉淀完全溶解,放出无色有刺激性气味的气体
【规范精练】
1.按要求回答下列问题:
(1)结晶析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:_____________________。
已知Na2S2O3·5H2O遇酸易分解:S2O+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
(2)榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。试设计实验证明榴石矿石中含有FeO(试剂任选,说明实验操作与现象):_________________________________________。
答案 (1)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液)于一试管中,滴加BaCl2溶液,若产生白色沉淀则说明含有Na2SO4杂质(合理即可)
(2)取矿石少许,加稀硫酸充分溶解后,向其中滴加酸性高锰酸钾溶液,若紫色褪去,证明矿石中含有FeO(不能加盐酸溶解)
2.为了探究AgNO3的氧化性,某化学兴趣小组设计了如下实验。
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 存在Fe3+ | |
取少量除尽Ag+后的溶液于试管中,加入________,振荡 | 存在Fe2+ |
【实验结论】 Fe的氧化产物为Fe2+和Fe3+。
答案 溶液呈红色 K3[Fe(CN)6]溶液 产生蓝色沉淀
解析 Fe3+遇KSCN溶液,溶液变红色。由于氯水与Fe2+反应现象不明显,应直接用K3[Fe(CN)6]溶液检验,如有蓝色沉淀出现,则证明Fe2+存在,否则不存在。