

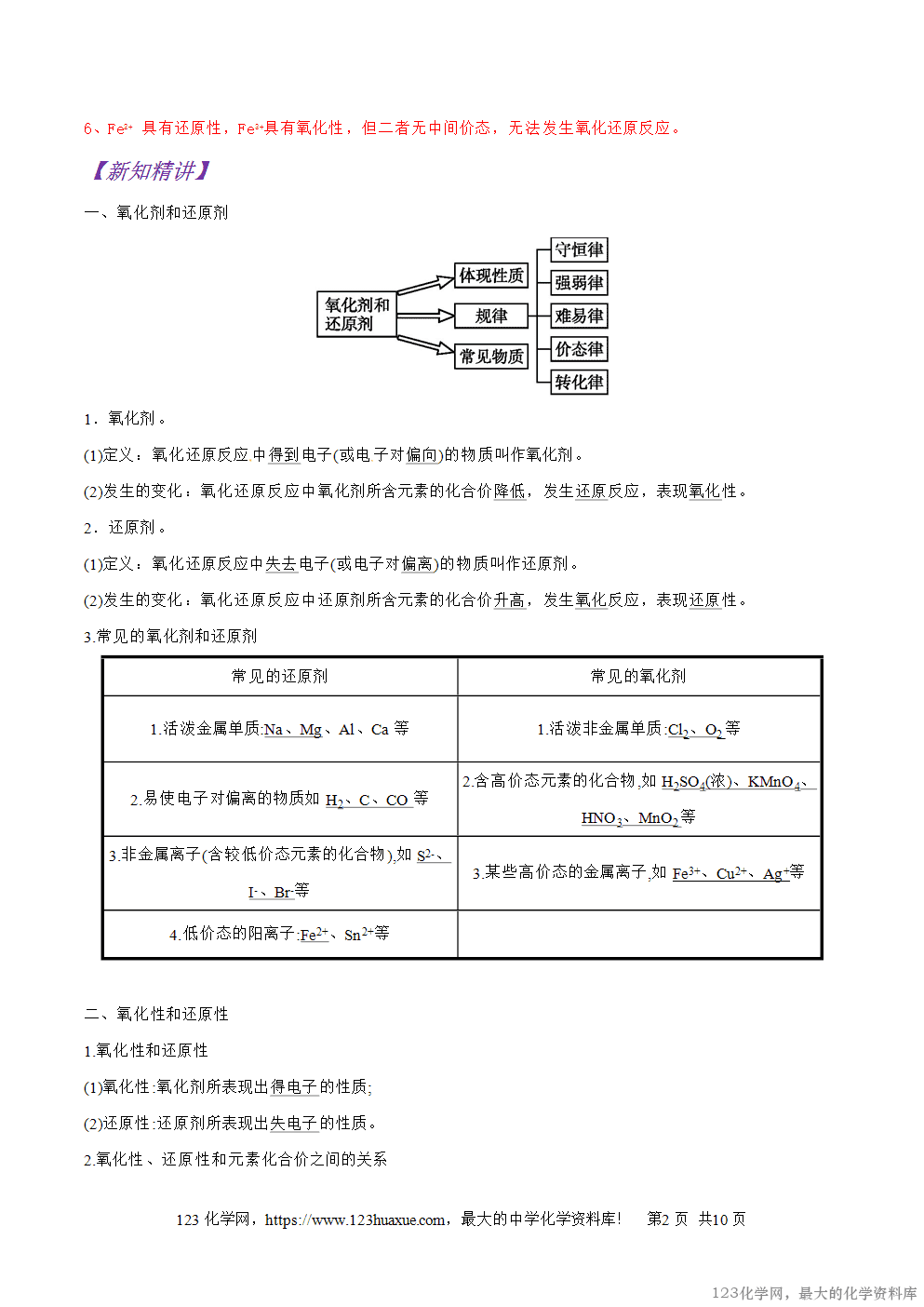



【知识回放】
1.指出下列反应的还原剂、氧化剂、氧化产物和还原产物。
(1)MnO2 + 4HCl=MnCl2 + Cl2↑+ 2H2O
(2)2H2S + SO2 =3S ↓ + 2H2O
(3) 2KClO3 =2KCl +3O2 ↑
2.化合价规则:
(1)在化合物中,各元素正、负化合价的代数和为 ;在单质中,元素的化合价为 。
(2)金属元素没有 ,非金属元素可以显正价,也可以显负价。
3.判断:
(1)非金属单质只具有氧化性( )
(2)金属阳离子只具有氧化性,不具有还原性( )[来源:Zxxk.Com]
(3)金属元素的原子失去电子的数目越多,该金属的还原性越强( )
(4)元素的价态越高,物质的氧化性越强( )
(5)某元素从化合态到游离态,则该元素一定被氧化( )
4.在一个反应中,氧化剂和还原剂的物质的量一定相等吗?
5.金属阳离子一定只有氧化性吗?
6.Fe2+具有较强的还原性,Fe3+具有较强的氧化性,二者之间能反应吗?为什么?
【答案】1、(1)氧化剂:MnO2 还原剂:HCl 还原产物:MnCl2 氧化产物:Cl2
(2)还原剂:H2S 氧化剂:SO2 S既是氧化产物又是还原产物
(3)KClO3 既是氧化剂又是还原剂 还原产物:KCl 氧化产物:O2
2.化合价规则:
(1)零 零
(2)负价
3.判断:
(1)× (2)× (3) × (4) × (5)×
4、在一个反应中氧化剂得电子数与还原剂失电子数相等,但氧化剂和还原剂的物质的量不一定相等。
5、金属阳离子可能有还原性,如Fe2+
6、Fe2+ 具有还原性,Fe3+具有氧化性,但二者无中间价态,无法发生氧化还原反应。