


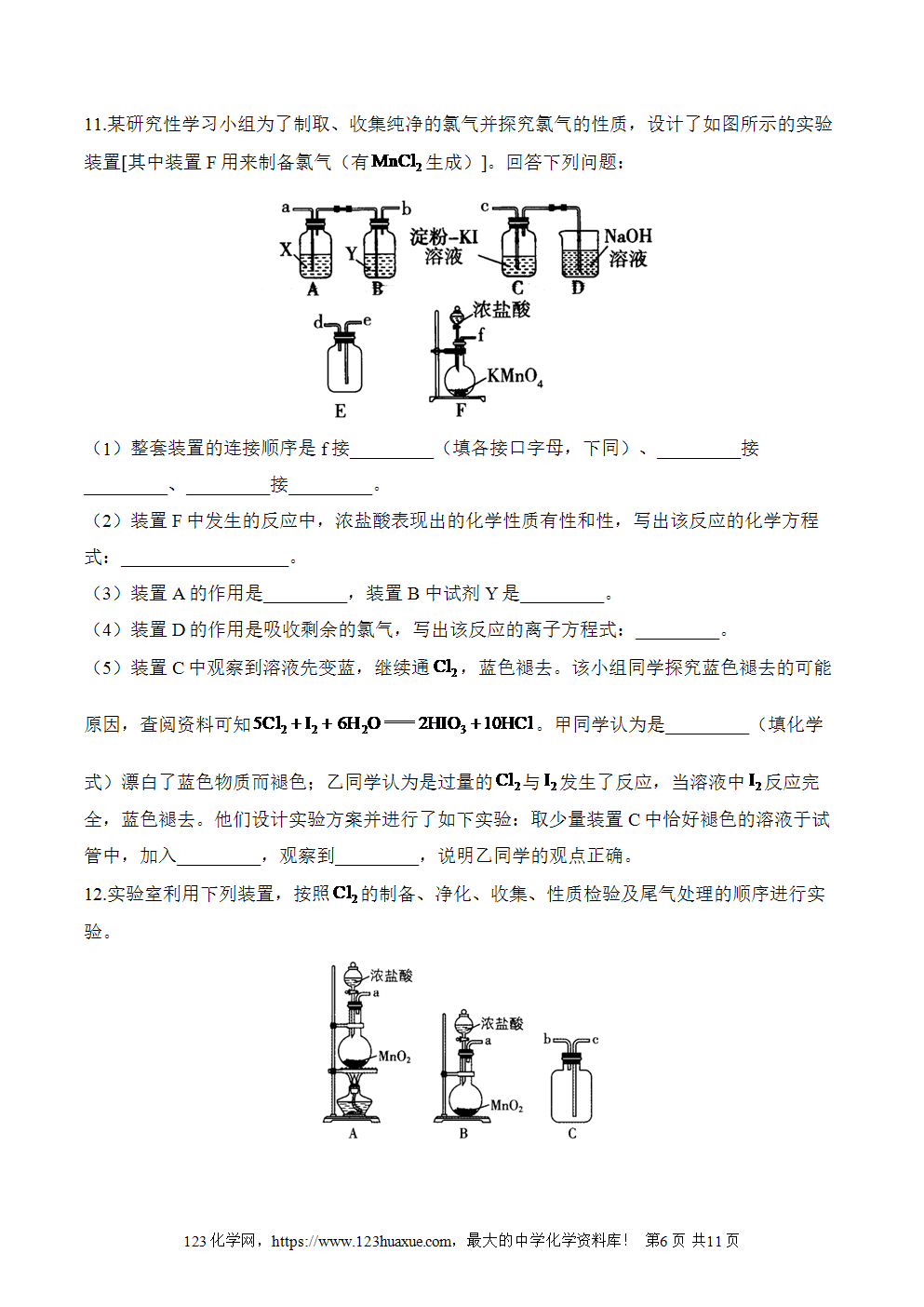



高中知识衔接
1.氯气的实验室制法
(1)反应原理:
(2)装置
说明:C装置的作用是除去Cl2中的HCl;D装置的作用是干燥Cl2;F装置的作用是:吸收多余的Cl2,防止污染环境。
(3)收集方法
①向上排空气法(Cl2密度大于空气)。
②排饱和食盐水法(Cl2在饱和NaCl溶液中的溶解度很小,且用此法可除去实验过程中挥发产生的HCl气体)。
③验满方法:用湿润的KI淀粉试纸检验。将湿润的KI淀粉试纸放在集气瓶口,若试纸变蓝,则证明Cl2已收集满。
(4) 尾气处理:Cl2有毒,易污染空气,需用NaOH溶液吸收。
(5)注意事项
①必须用浓盐酸,MnO2与稀盐酸不反应。
②为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,减少HCl的挥发。
③实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。
④尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全。
⑤随着反应的进行盐酸浓度变小,故MnO2足量时,盐酸不能完全反应。
2.氯离子的检验方法
(1)操作方法:向未知溶液中先加AgNO3溶液,再加稀HNO3。
(2)现象:产生白色沉淀,加稀硝酸时,沉淀不溶解。
(3)原理:Ag++Cl-===AgCl↓。
(4)加入稀硝酸的目的:排除CO3(2-)等离子的干扰。
巩固练习
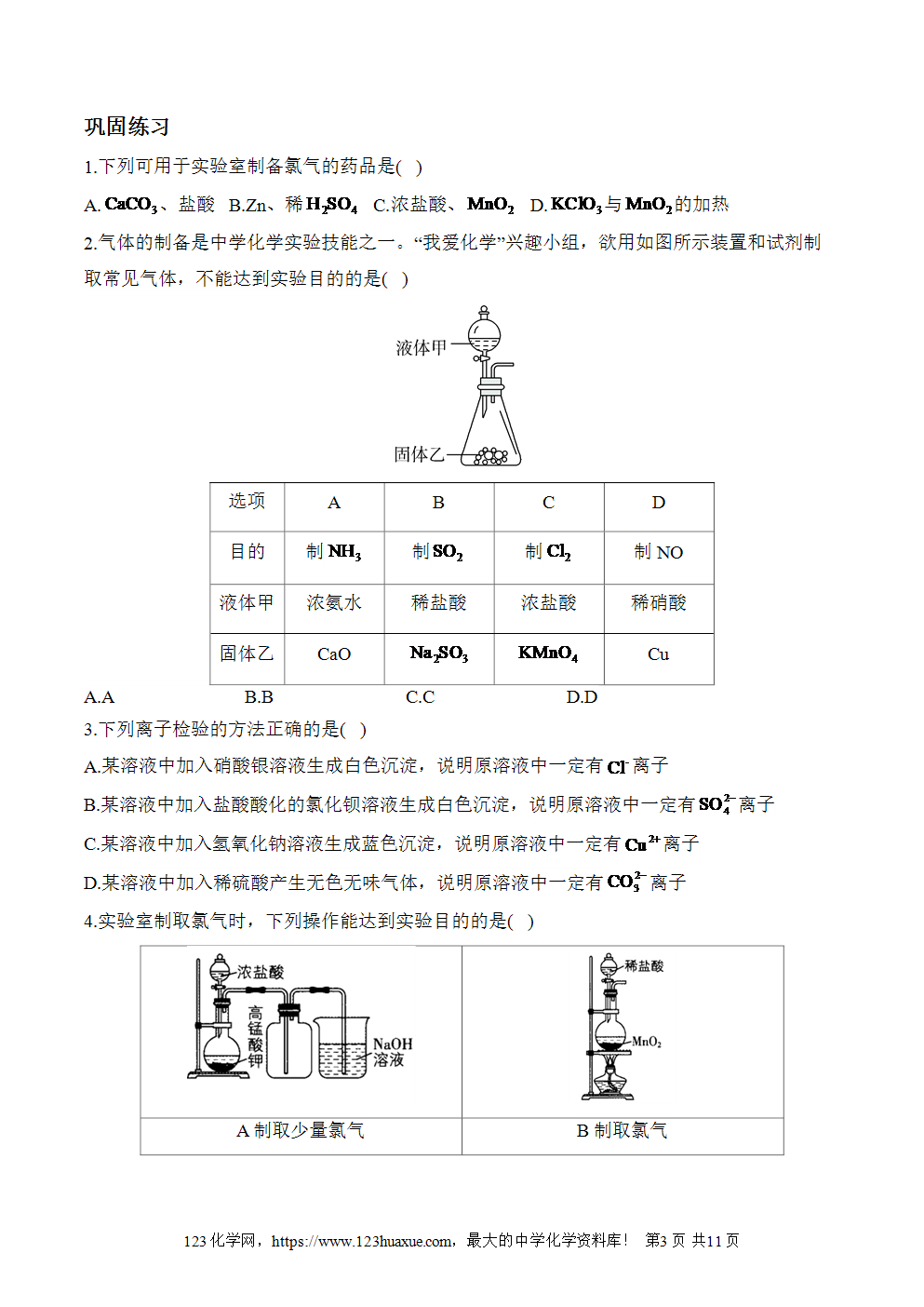
1.下列可用于实验室制备氯气的药品是( )
A.、盐酸 B.Zn、稀 C.浓盐酸、 D.与的加热
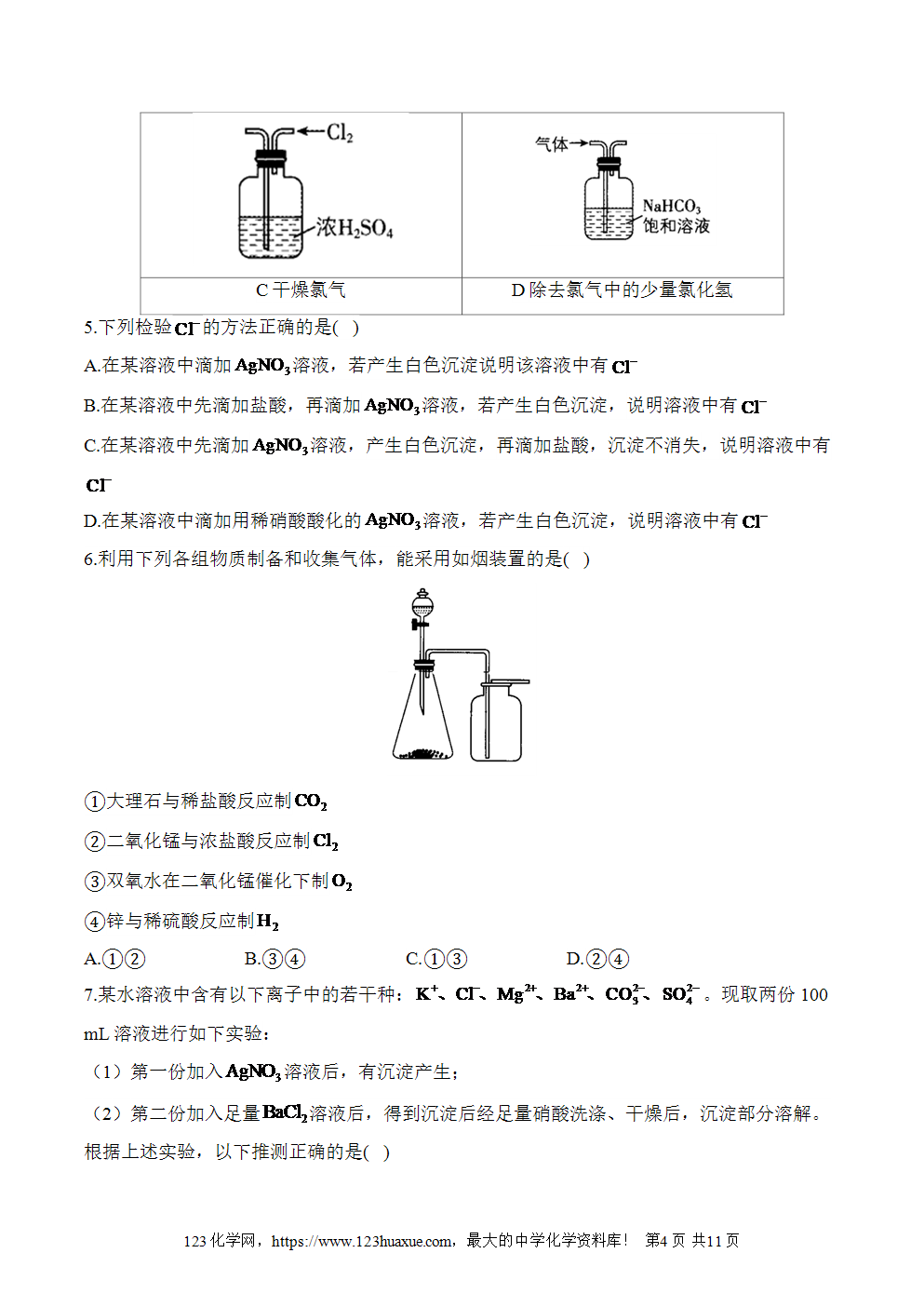
2.气体的制备是中学化学实验技能之一。“我爱化学”兴趣小组,欲用如图所示装置和试剂制取常见气体,不能达到实验目的的是( )