


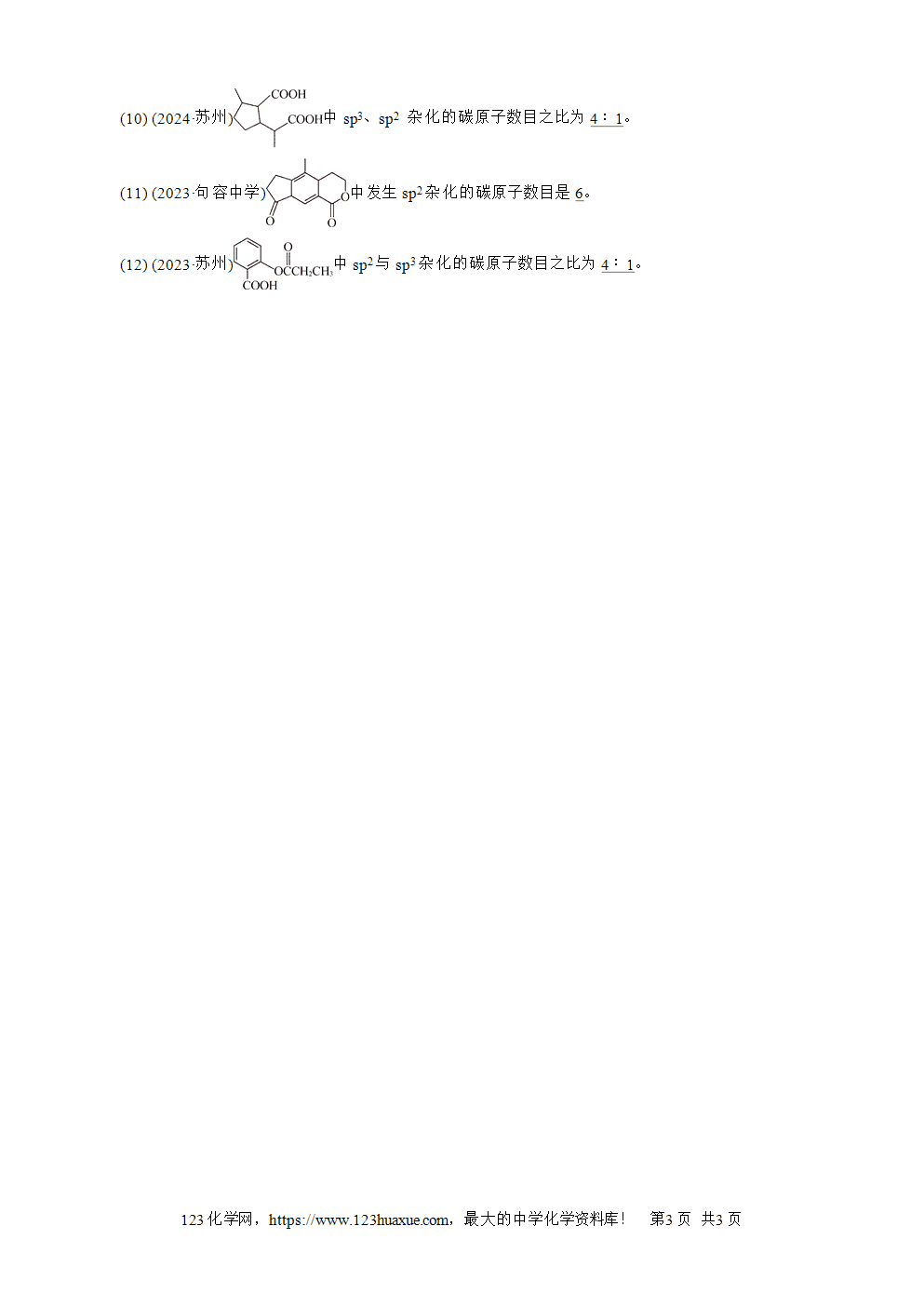
练习3 分子、离子的空间结构
1. 判断正误(正确的打“√”,错误的打“×”)。
(1) (2024·连云港一模)CH4的空间结构为平面正方形(×)
(2) (2023·华罗庚中学)ClO3(-)的空间结构为平面三角形(×)
(3) (2023·华罗庚中学)ClO4(-)空间结构为正四面体形(√)
(4) (2024·连云港中学)CO2的空间结构为V形(×)
(5) (2024·镇江)HClO分子的空间结构为V形,键角等于109°28′(×)
(6) (2024·无锡)二硫化氢(H2S2)分子的结构为直线形(×)
(7) (2024·苏州)H2S空间结构为直线形(×)
(8) (2023·常州中学)N2H4分子的空间结构为平面形(×)
(9) (2023·如皋)NH4(+)的空间结构为正四面体形(√)
(10) (2023·连云港一调)NCl3空间结构为平面正三角形(×)
(11) (2023·常熟期中)SO2与CO2分子的空间结构相同(×)
(12) (2024·盐城期中)PO4(3-)和SO4(2-)的空间结构相同(√)
(13) (2023·海门期末)SOCl2分子的空间结构为平面三角形(×)
(14) (2024·海安中学)NH3与H2O的VSEPR模型均为四面体形(√)
(15) (2023·华罗庚中学)SO2的VSEPR模型:(√)
2. 判断正误(正确的打“√”,错误的打“×”)。
(1) (2024·宿迁三模)SO3和SO3(2-)中S原子的杂化轨道类型均为sp2(×)
(2) (2024·通州模拟)[Al(OH)4]-中Al原子的杂化轨道类型为sp2(×)
(3) (2024·如皋适应性二)HCO3(-)中C原子的杂化轨道类型为sp2(√)
(4) (2023·海门二调)AsH3与N2H4中,中心原子的杂化轨道类型相同(√)
(5) (2023·连云港期中)H2O2分子中氧原子的杂化轨道类型均为sp3(√)
(6) (2024·苏州期末)PO4(3-)中P原子的杂化轨道类型sp3(√)
(7) (2024·扬州期末)HClO中心原子的杂化轨道类型sp2(×)
(8) (2024·海安中学期初)甲醇和二氧化碳分子中碳原子杂化方式不同(√)
(9) (2023·扬州期初)ClO3(-)、SO4(2-)中心原子的杂化方式均为sp3(√)
(10) (2023·苏州期中)BF3与B2H6 (结构式为)中心原子均采取sp2杂化(×)
(11) (2023·南菁、梁丰中学期初)NF3分子中氮原子的杂化轨道类型为sp2(×)
(12) (2024·南通一模)SO3和H2O中心原子的杂化轨道类型相同(×)
(13) (2024·南通二模)NO2(-)和NO3(-)中N原子均采取sp2杂化(√)