



第8讲 铁及其化合物
练习1 铁 铁的氧化物 铁的氢氧化物
1. (2023·连云港期末)下列有关铁及其化合物的性质与用途具有对应关系的是(D)
A. Fe粉能被磁铁吸引,可用作食品袋中的抗氧化剂
B. Fe2O3能与盐酸反应,可用于制作红色颜料
C. FeS难溶于水,可用于除去废水中的Cu2+
D. K2FeO4具有强氧化性,可用作水的杀菌消毒剂
【解析】 Fe粉用作食品袋中的抗氧化剂利用的是Fe具有还原性,A错误;Fe2O3属于碱性氧化物,能与盐酸反应生成盐和水,Fe2O3制作红色颜料的原因是Fe2O3的颜色为红棕色,B错误;FeS与Cu2+生成更难溶的CuS,C错误。
2. (2024·无锡四校期初)在指定条件下,下列有关铁单质的转化不能实现的是(B)
A. Fe(s)()少量Cl2gFeCl3(s)
B. Fe(s)()H2OgFe2O3(s)
C. Fe(s)过量稀硝酸(――――→)Fe(NO3)3(aq)
D. Fe(s)()CuSO4aq(――→)FeSO4(aq)
【解析】 Fe与水蒸气高温生成Fe3O4,B错误。
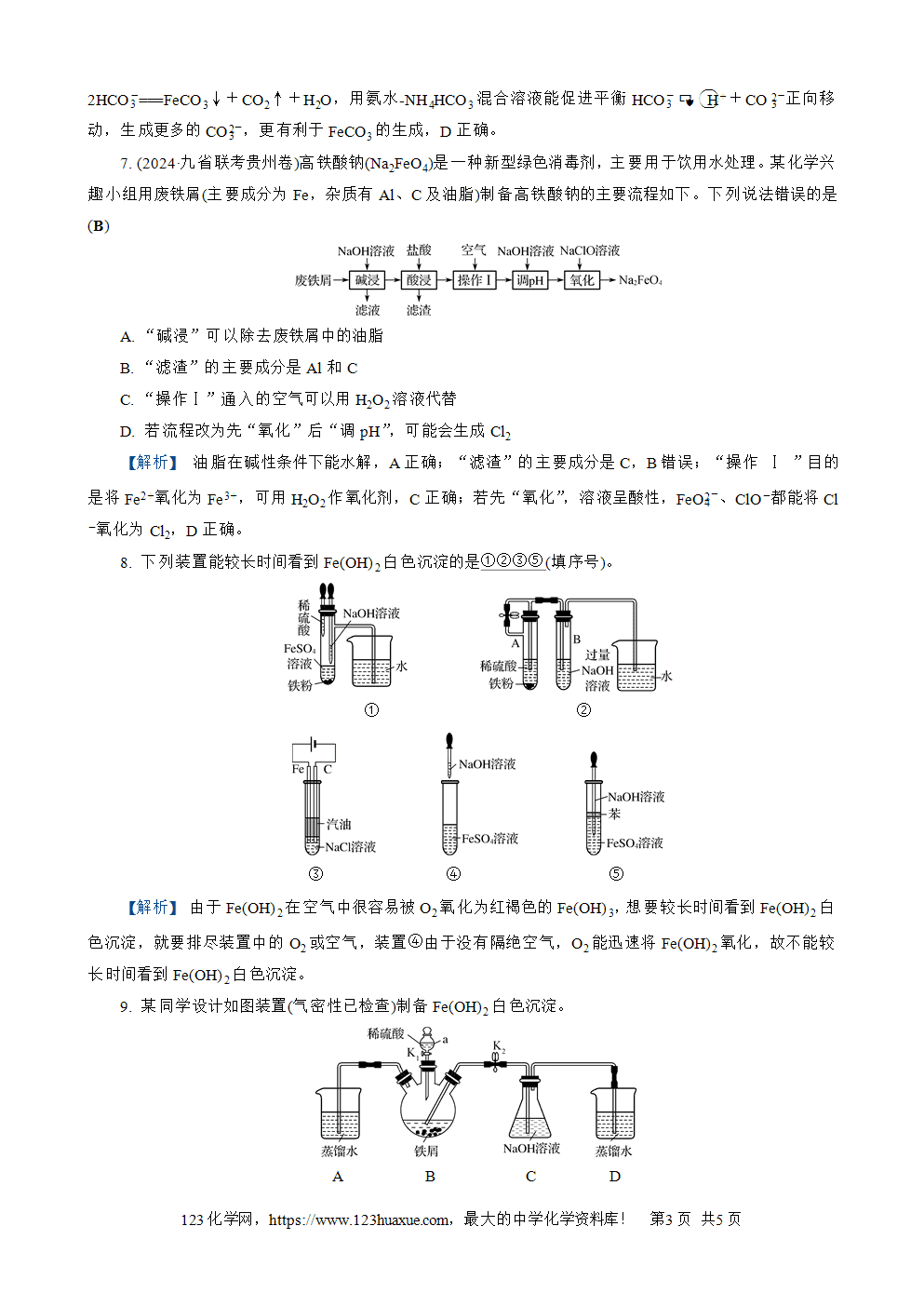
3. (2024·淮安期末)利用下列装置进行实验,能达到相应实验目的的是(B)
甲 乙 丙 丁
A. 装置甲可用于由FeSO4溶液制备FeSO4·7H2O
B. 装置乙可用于实验室制备少量Fe(OH)2
C. 装置丙中滴加KSCN溶液,溶液不变红,可证明锌比铁活泼
D. 装置丁的肥皂液中产生无色气泡,可证明铁粉与水蒸气反应生成O2
【解析】 由FeSO4溶液制备FeSO4·7H2O需要在蒸发皿中蒸发浓缩然后冷却结晶,A错误;装置乙中首先滴加稀硫酸,稀硫酸和铁反应生成FeSO4和H2,H2排净装置中空气,再滴加NaOH溶液,反应生成Fe(OH)2沉淀,B正确;装置丙中滴加KSCN溶液,溶液不变红,只能说明不存在Fe3+,但是不能证明锌比铁活泼,C错误;装置丁中铁粉和水蒸气高温生成Fe3O4和H2,D错误。
4. (2023·扬州中学)FeCl3易水解、易升华,实验室用如图所示装置制备少量FeCl3。下列有关说法正确的是(C)
A. 实验开始,先点燃酒精灯,再滴加浓盐酸
B. 实验时若Cl2不足量,则可能生成FeCl2
C. 装置丙的作用是收集FeCl3
D. 装置丁中CaCl2的作用是吸收未反应的Cl2
【解析】 实验开始,先滴加浓盐酸,利用生成的氯气排尽装置内的空气,以免铁粉与氧气发生反应,A错误;铁与氯气反应只能生成FeCl3,B错误;装置丙的作用是收集冷凝后的固体氯化铁,C正确;CaCl2与氯气不反应,CaCl2的作用是防止NaOH溶液中的水蒸气进入丙中使FeCl3水解,D错误。
5. 《新修本草》中描述“青矾”为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色”。青矾加热时的反应为2(FeSO4·7H2O)△(=====)Fe2O3+SO2↑+H2SO4+13H2O。下列说法正确的是(C)
A. 产物中含有3种非金属氧化物
B. 所得赤色物质为FeSO4
C. 反应为分解反应
D. 铁元素发生还原反应
【解析】 产物中含有SO2和H2O共2种非金属氧化物,A错误;赤色物质为Fe2O3,B错误;该反应由1种物质生成4种物质,为分解反应,C正确;反应中Fe元素由+2价升到+3价,失去电子,发生氧化反应,D错误。
6. (2023·海安中学)实验室由铁泥(主要成分为铁的氧化物及少量氧化钙)制备软磁性材料α-Fe2O3,其主要实验流程如图。
已知:Ksp(CaF2)=5.3×10-9,下列有关说法错误的是(C)
A. “酸浸”时,可通过延长时间来提高铁元素浸出率
B. “还原”过程中除生成Fe2+外,还会生成H2
C. “除杂”时,酸性条件下,更有利于Ca2+去除
D. “沉铁”时,用氨水-NH4HCO3混合溶液代替NH4HCO3溶液,更有利于生成FeCO3沉淀
【解析】 “酸浸”时,延长时间可使铁泥与酸充分接触,使铁元素充分浸出,A正确;“酸浸”过程中酸适当过量,“还原”过程中发生的反应有2Fe3++Fe===3Fe2+、Fe+2H+===Fe2++H2↑,B正确;酸性条件下,F-与H+生成HF,不利于CaF2沉淀,C错误;沉铁时加入NH4HCO3溶液,发生反应:Fe2+