



练习2 含氯化合物之间的转化
1. (2024·扬州考前模拟)氯及其化合物的转化具有重要应用。下列说法错误的是(A)
A. 实验室利用浓盐酸的氧化性制备Cl2
B. 利用ClO2的氧化性对饮用水进行消毒
C. Cl2与石灰乳反应制备漂白粉及漂白粉使用时加水浸泡片刻的物质转化:
Cl2石灰乳Ca(ClO)2H2OHClO
D. 制备FeCl3的路径之一:HClFeFeCl2Cl2FeCl3
【解析】 实验室利用浓盐酸制备氯气,Cl元素化合价升高,利用浓盐酸还原MnO2制得Cl2,A错误。
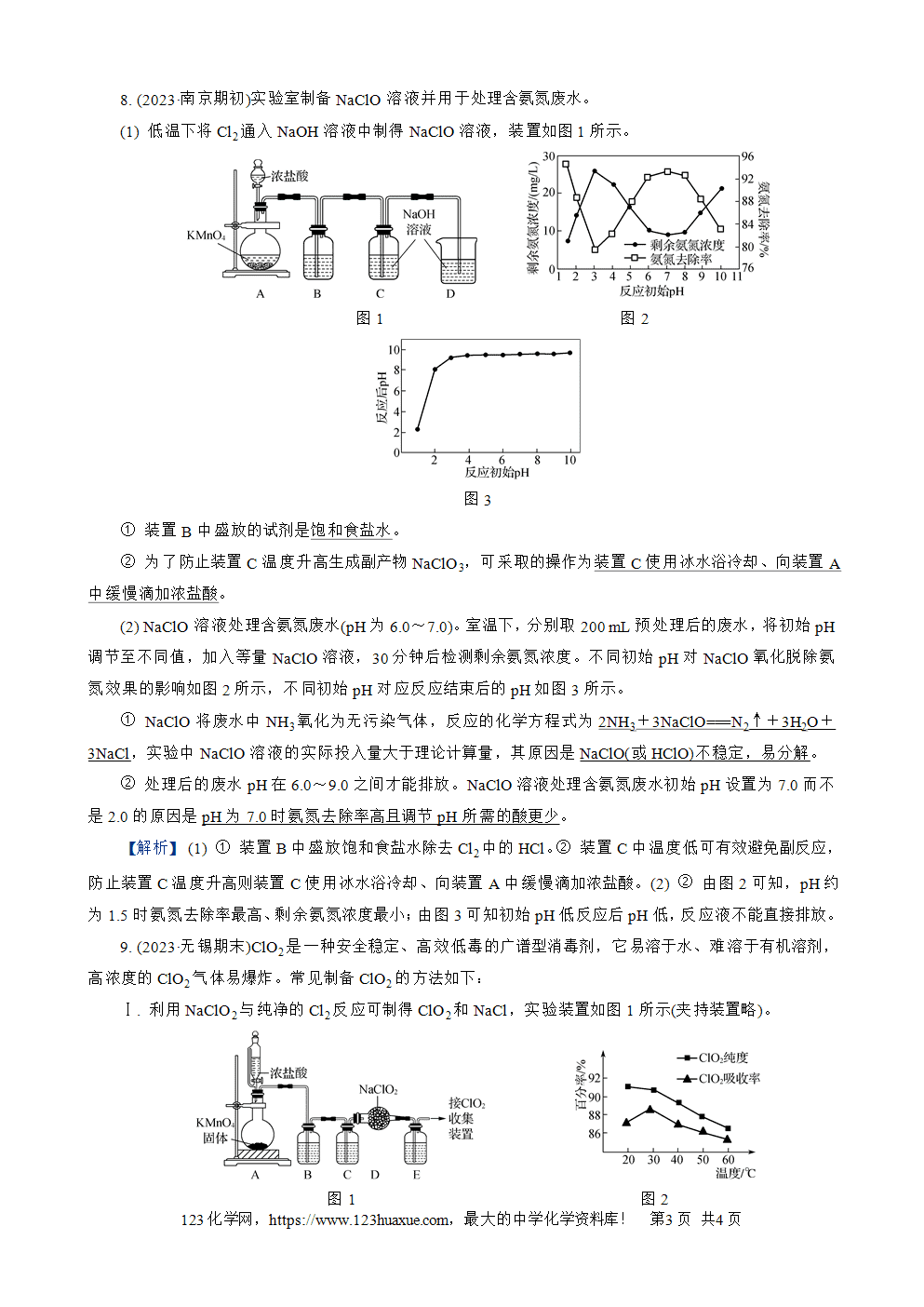
2. (2023·扬州期初)下列含氯物质的转化过程均正确的是(C)
A. 漂白粉过量CO2HClO(aq)光照Cl2(g)
B. MgCl2(aq)加热无水MgCl2电解Mg
C. NaCl(aq)通电Cl2(g) Fe FeCl3
D. NaCl(aq)过量CO2NaHCO3(aq)△Na2CO3(s)
【解析】 HClO见光分解为HCl和O2,A错误;MgCl2水解生成Mg(OH)2和HCl,加热促进水解,盐酸挥发,加热MgCl2溶液得不到无水MgCl2,B错误;NaCl溶液与CO2不反应,D错误。
3. (2024·东台期末)物质分类和转化是学习化学的重要思想方法。部分含氯物质的分类与相应化合价关系如图所示,下列推断不合理的是(C)
A. ①的水溶液能与④反应生成②
B. 用③代替②进行自来水消毒更安全
C. ②与SO2按物质的量比1∶1通入水中,再滴入品红溶液,溶液呈无色
D. 由ClONO2在表中的位置可推测其可能具有强氧化性,能水解生成两种酸
【解析】 ①为HCl、②为Cl2、③为ClO2、④为次氯酸盐。2H++Cl-+ClO-===Cl2↑+H2O,A正确;ClO2氧化性更强,用ClO2代替Cl2进行自来水消毒效率高,更安全,B正确;Cl2+SO2+2H2O===H2SO4+2HCl,Cl2与SO2按物质的量比1∶1恰好完全反应生成H2SO4和HCl,再滴入品红溶液,品红不褪色,溶液呈红色,C错误;ClONO2中Cl元素为+1价、N元素为+5价,+1价的Cl和+5价的N都有强氧化性,ClONO2水解可生成硝酸和次氯酸,D正确。
4. 已知:Cl2通入冷的NaOH溶液可制得NaClO,通入热的NaOH溶液则产生NaClO3;H3PO2(次磷酸)是一元弱酸、具有还原性;HClO3是强酸。下列化学反应表示正确的是(D)
A. (2024·盐城考前模拟)次磷酸与NaClO溶液:H3PO2+3NaClO===Na3PO2+3HClO
B. (2024·盐城考前模拟) Cl2与热的NaOH溶液:3Cl2+2OH-+H2O△ClO3+5Cl-+4H+
C. (2024·镇江期初)用Na2CO3溶液吸收Br2(g):Br2+Na2CO3===NaBr+NaBrO3+CO2
D. (2024·镇江期初)用食盐水电解制备NaClO3的阳极反应:Cl--6e-+3H2O===ClO3+6H+
【解析】 H3PO2具有还原性,ClO-具有氧化性,二者发生氧化还原反应,A错误;Cl2与热的NaOH溶液:3Cl2+6OH-△ClO3+5Cl-+3H2O,B错误;用Na2CO3溶液吸收Br2(g):3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2,C错误。
5. (2024·九省联考广西卷)下列指定反应的离子方程式书写正确的是(A)
A. SO2与酸性NaClO3溶液反应制备ClO2:SO2+2ClO3===2ClO2+SO4
B. 碱性溶液中ClO2与Na2O2反应制备NaClO2:2ClO2+2Na2O2===2ClO2+O2+2Na+
C. NaClO2在强酸溶液中生成ClO2和NaCl:4H++3ClO2===2ClO2↑+Cl-+2H2O
D. 弱酸HClO2在水中分解生成O2:ClO2===O2↑+Cl-
【解析】 SO2与NaClO3制备ClO2,SO2被氧化为SO4,A正确;该离子方程式中原子不守恒、得失电子不相等,B错误;该离子方程式中得失电子不相等,C错误;HClO2为弱酸,离子方程式中不拆开,D错误。