




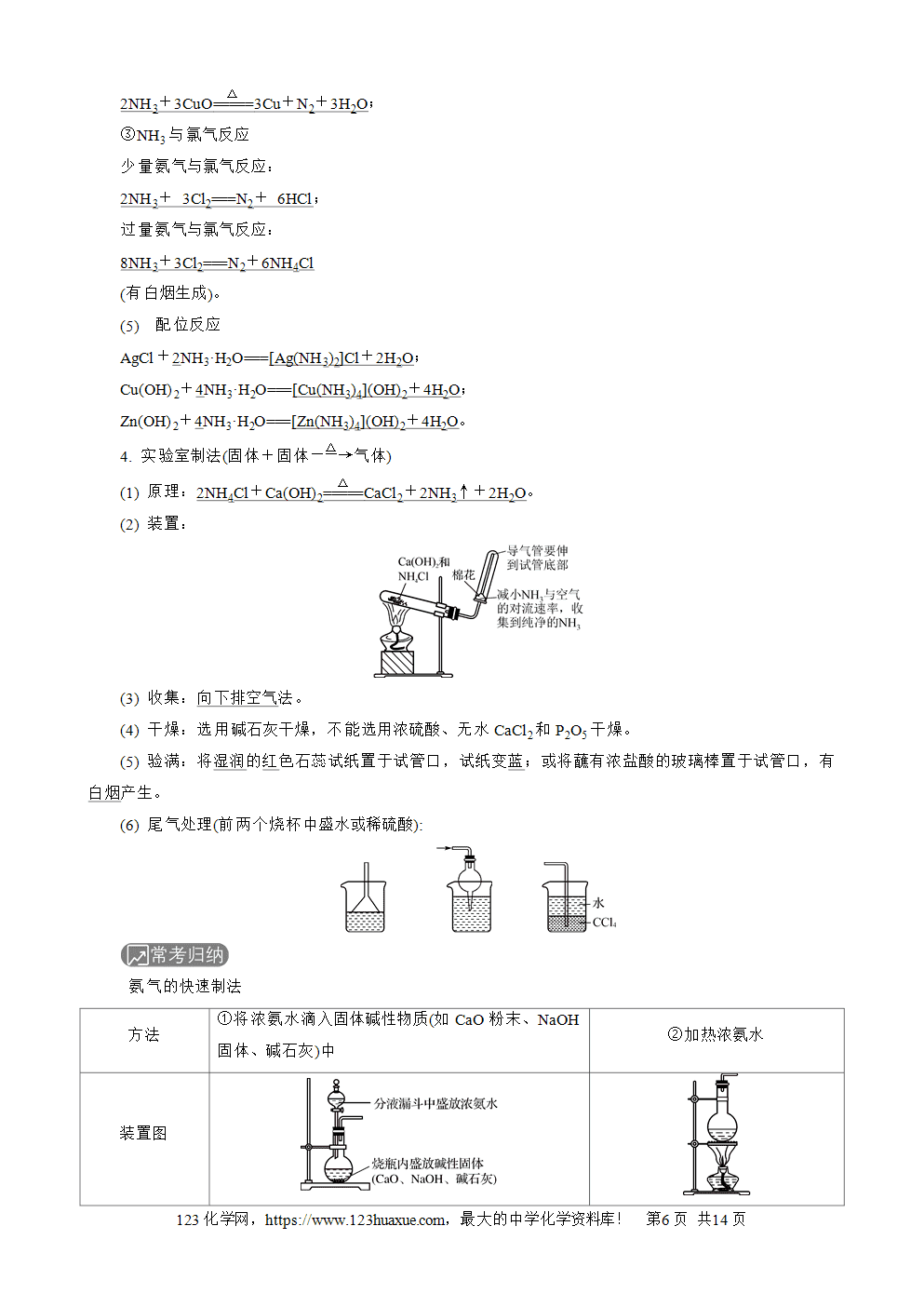

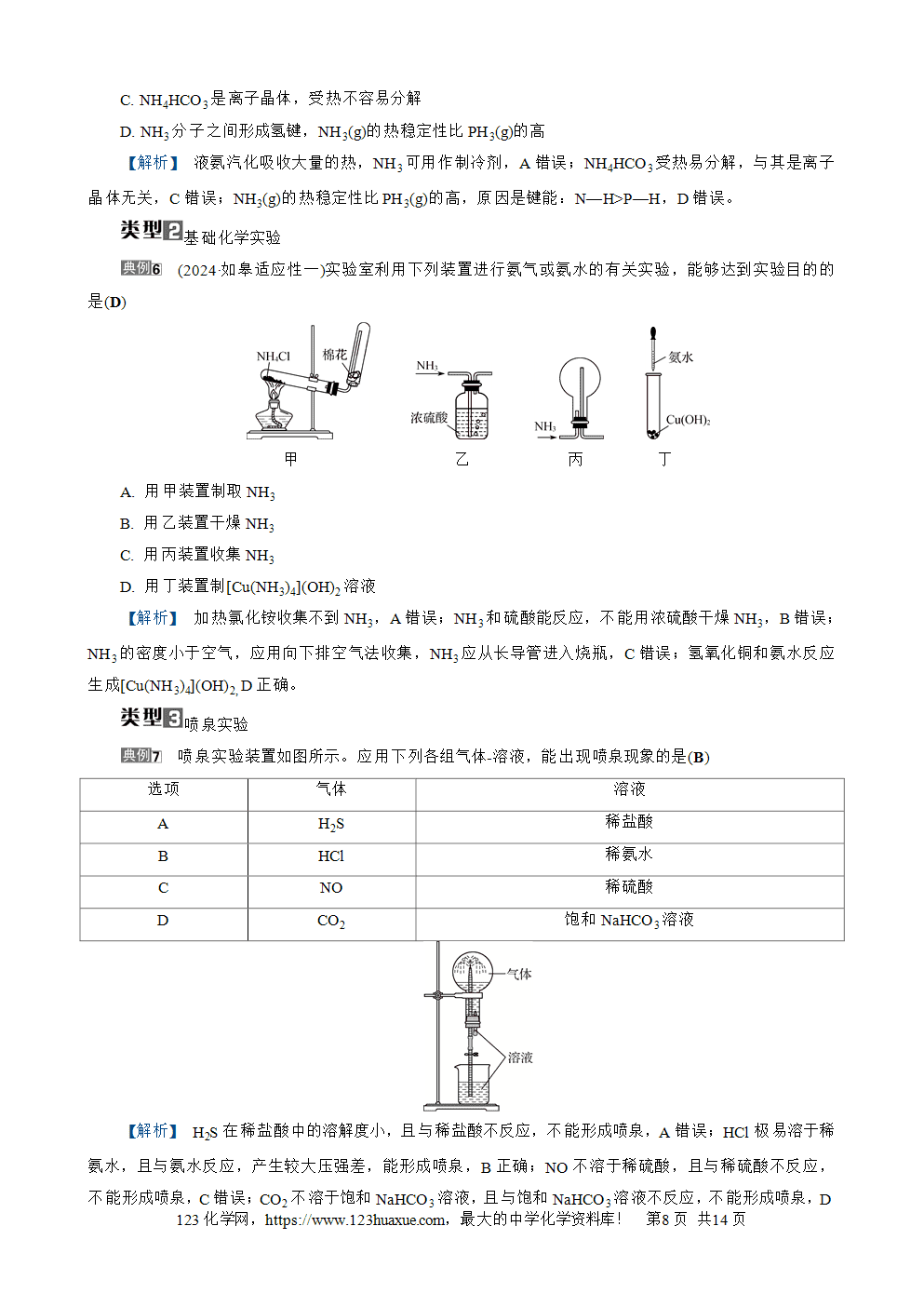




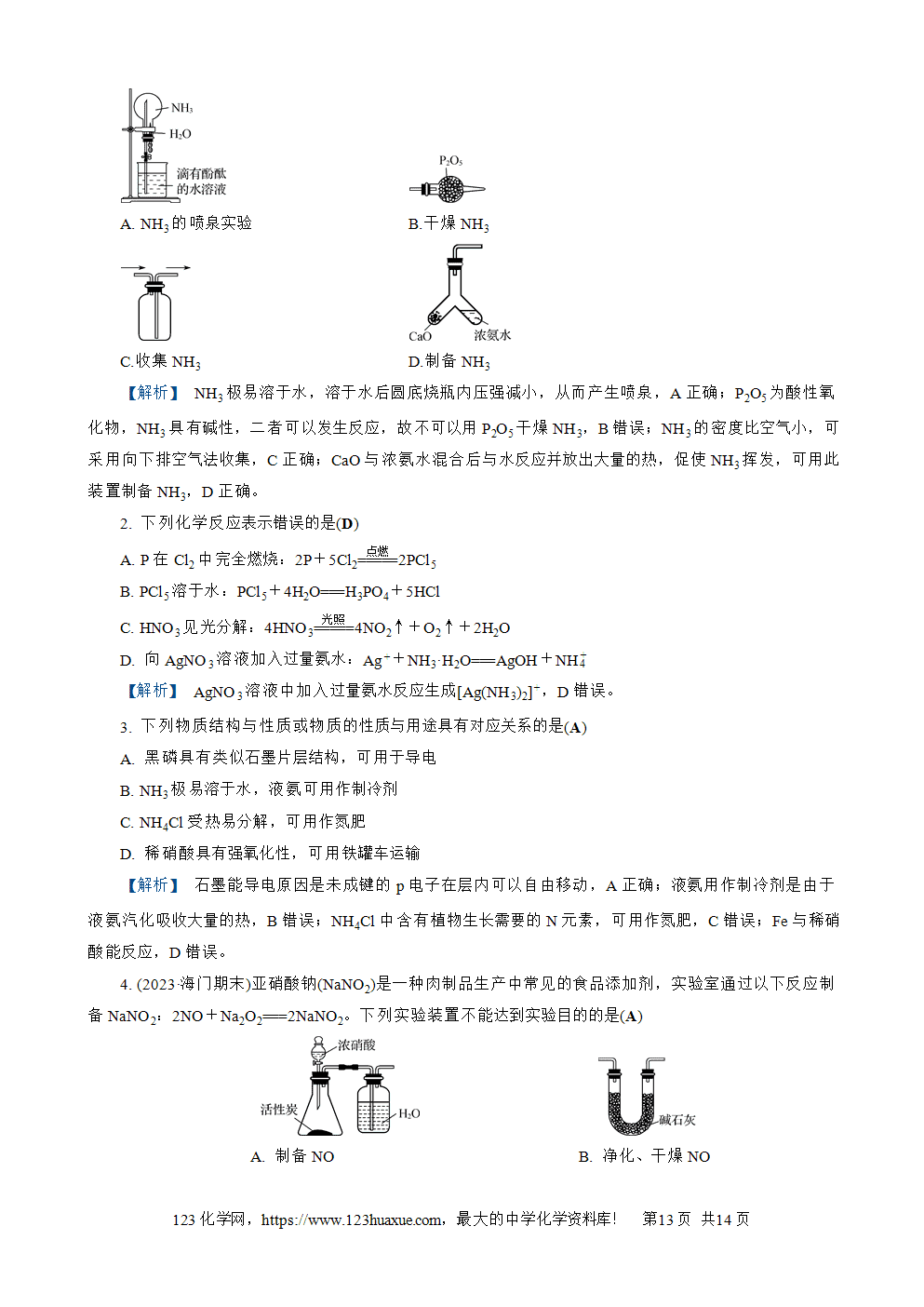
考点1 氮气 氮的氧化物
知 识 梳 理
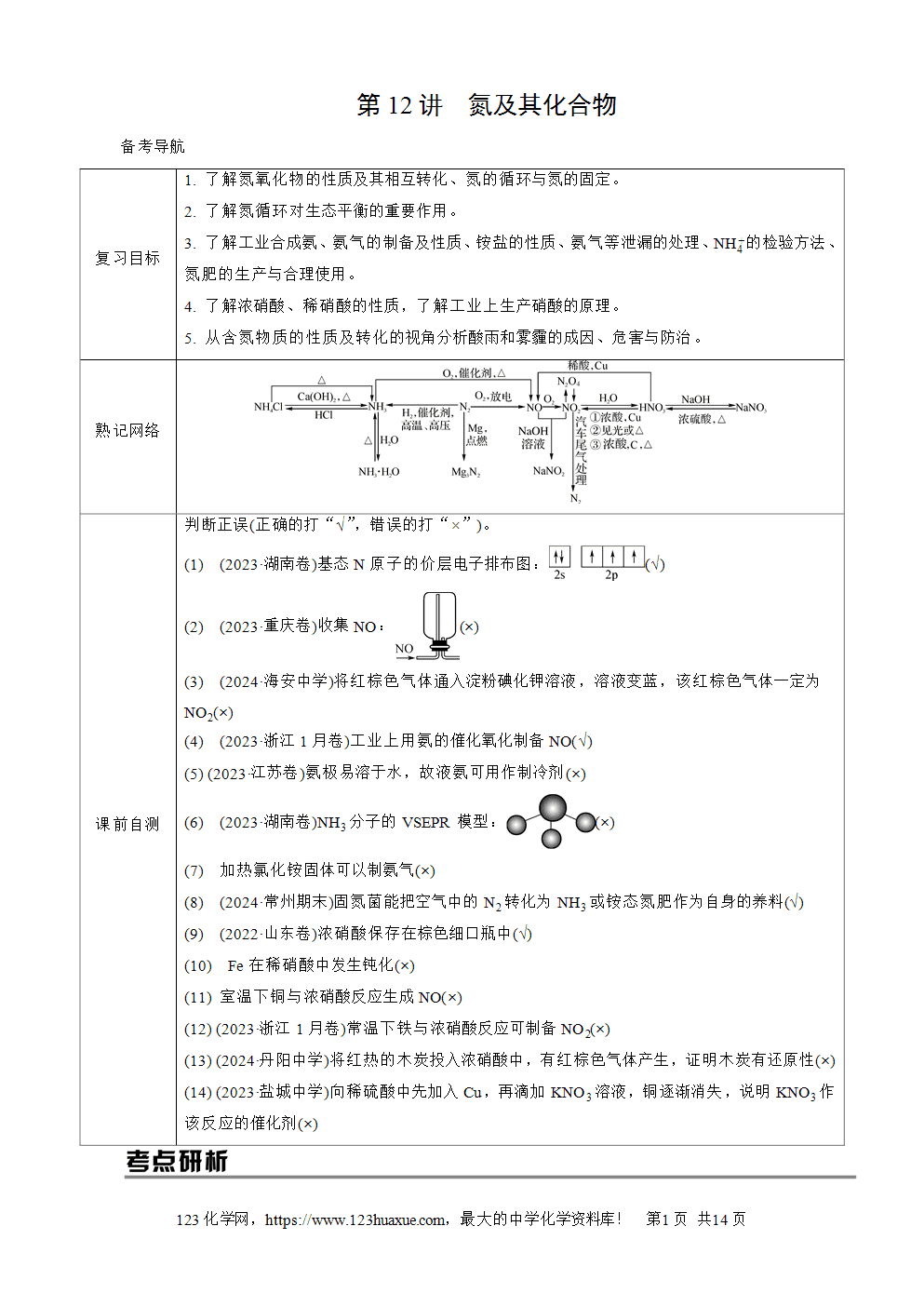
氮元素的存在形态和固氮
1. 氮元素的存在形态
(1) 游离态——N2(空气中含量最多的气体)。
(2) 化合态——动植物体内、土壤、岩石和水体中。
2. 氮的固定:将游离态氮转化为化合态氮的过程。
(1) 自然固氮:通过闪电释放的能量将空气中的N2转化为含氮的化合物,主要反应为N2+O2放电()2NO。
(2) 人工固氮:人类通过控制条件,将氮气转化为氮的化合物,主要反应为N2+3H2高温、高压2NH3。
(3) 生物固氮:豆科植物根瘤菌将N2转化成氨。
氮气的物理性质
氮气是无色、无味、难溶于水的气体。
氮气的结构及化学性质
1. N2的结构
电子式:·(·)N⋮⋮N·(·),结构式:N≡N,N2分子中有1个σ键、2个π键。
2. N2的化学性质
氮氮三键的键能大,氮气化学性质较稳定。
(1) 与O2反应:N2+O2放电(=====)2NO
(2) 与H2反应:N2+3H2高温、高压2NH3(工业合成氨)
(3) 与Mg反应:N2+3Mg点燃(=====)Mg3N2
氮气的用途
1. 工业上合成氨、制硝酸。
2. 灯泡填充气。
3. 保存粮食、水果等食品。
4. 医学上用液氮作冷冻剂。
5 .代替稀有气体作焊接金属的保护气。
氮的氧化物
氮有多种价态的氧化物:+1(N)2O、+2(N)O、+3(N)2O3、+4(N)O2、+4(N)2O4、+5(N)2O5等。
1. NO和NO2的性质比较