




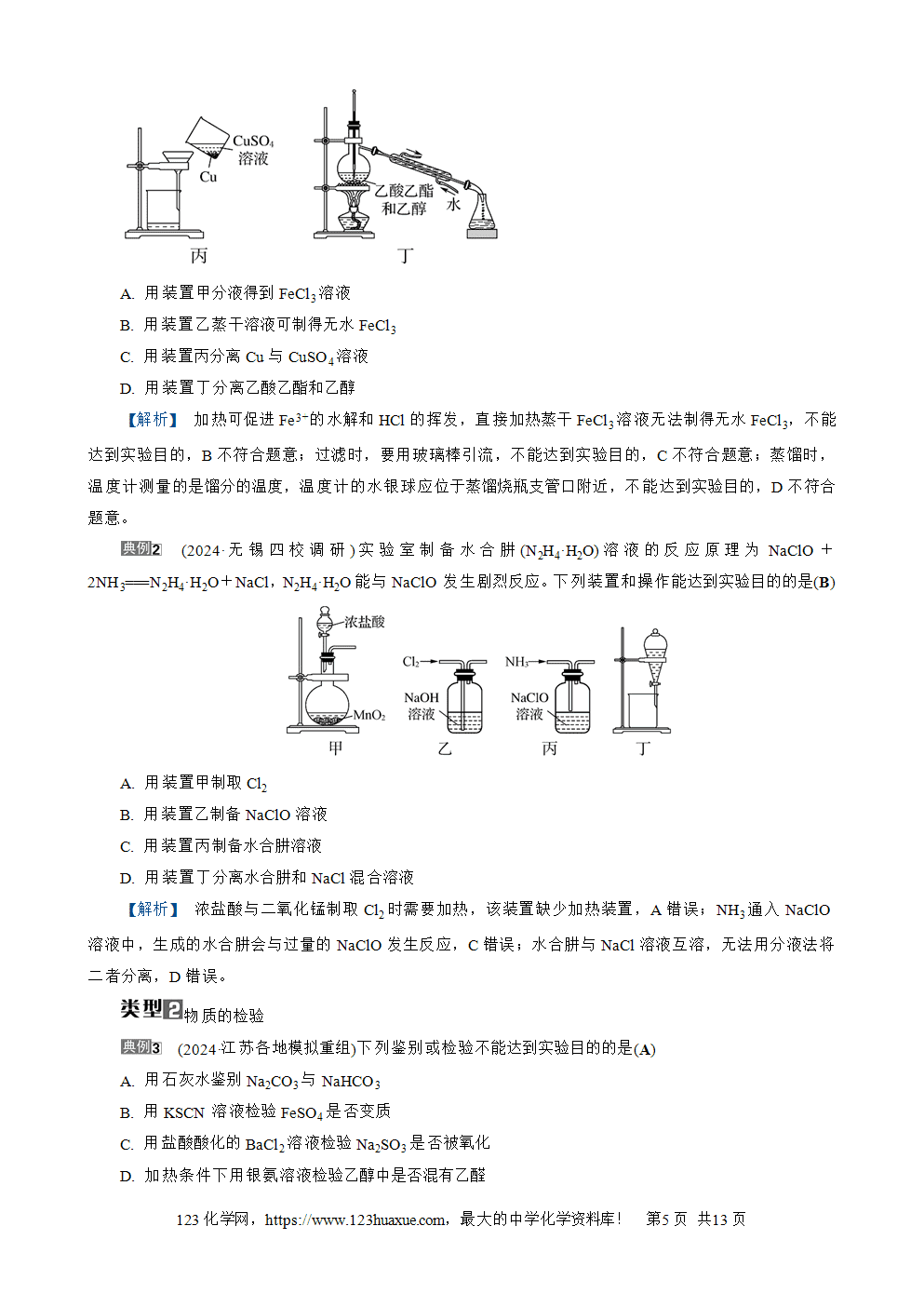







判断正误(正确的打“√”,错误的打“×”)。
(1) 室温下,向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中混有的少量苯酚(×)
(2) 煮沸自来水可除去其中的Ca(HCO3)2(√)
(3) 除去KCl中混有的MnO2,应该选用蒸发结晶法(×)
(4) 除去碘中的NaCl,应该选用加热升华法(√)
(5) 除去酸性MgCl2溶液中混有的少量FeCl3:加入足量的Mg(OH)2 并过滤(√)
(6) 除去NaCl溶液中混有的少量Na2S:加入适量AgCl后再过滤(√)
(7) 除去氯化钠固体中混有的少量纯碱:加入过量氯化钙溶液,过滤、蒸发、结晶(×)
(8) 除去乙醇中混有的少量乙酸:先加生石灰,过滤后再蒸馏(√)
(9) 除去CO2中混有的少量HCl:用饱和碳酸钠溶液洗气(×)
(10) 除去NO2中混有的少量NO:用水洗气(×)
(11) 除去FeCl2溶液中混有的少量FeCl3:加入过量铁粉,过滤(√)
(12) 除去铜粉中混有的少量CuO:加入适量稀硝酸后,过滤、洗涤(×)
(13) 除去CO中混有的少量CO2:依次通过盛有NaOH溶液、浓硫酸的洗气瓶(√)
(14) 除去Cl2中混有的少量HCl:依次通过盛有饱和食盐水、浓硫酸的洗气瓶(√)
(15) 除去Na2CO3固体中混有的少量NaHCO3固体:加热(√)
除杂“四原则”、常见提纯方法、除杂操作“四小心”
1. 除杂“四原则”
(1) 不增,不得引入新杂质,如用调节pH沉淀某些离子时,不能引入易溶的难以除去的其他离子。
(2) 不减,尽量不减少被提纯和分离的物质,如通过调pH沉淀Fe3+时,不要把目标产物离子也沉淀了,注意控制pH范围。
(3) 易分,应使被提纯或分离的物质与其他物质易分离,比如易沉淀、可以产生气体、可以发生分层(易分液)等。
(4) 易复原,被提纯物质转化后要易被复原。
2. 常见提纯方法
(1) 加热法:使杂质分解、氧化、升华,如通过加热除去过量的H2O2,通过升华提纯碘单质。
(2) 沉淀法:加入沉淀剂或调pH使杂质转化为沉淀,如调pH沉淀Fe3+达到除杂目的。
(3) 氧化还原反应:加入氧化剂或还原剂使杂质转化为被提纯的物质,如除去杂质离子Fe2+,可先加入H2O2将Fe2+氧化成Fe3+,再通过调pH沉淀Fe3+达到除杂目的。
3. 除杂操作“四小心”
(1) 除杂试剂要过量。
(2) 过量试剂需除去。
(3) 选择的途径要最佳。
(4) 除去多种杂质时,要考虑加入试剂的先后顺序。