
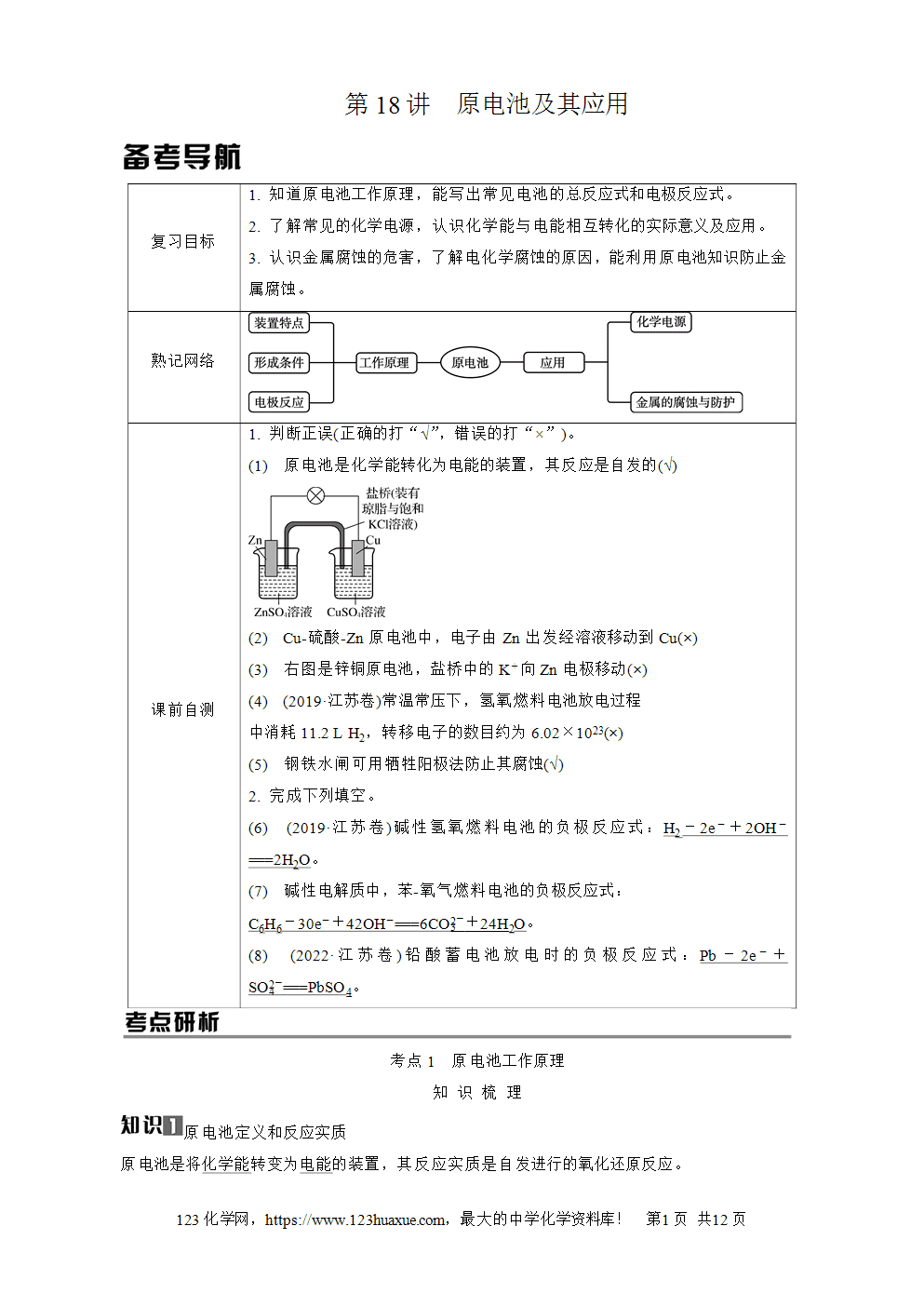
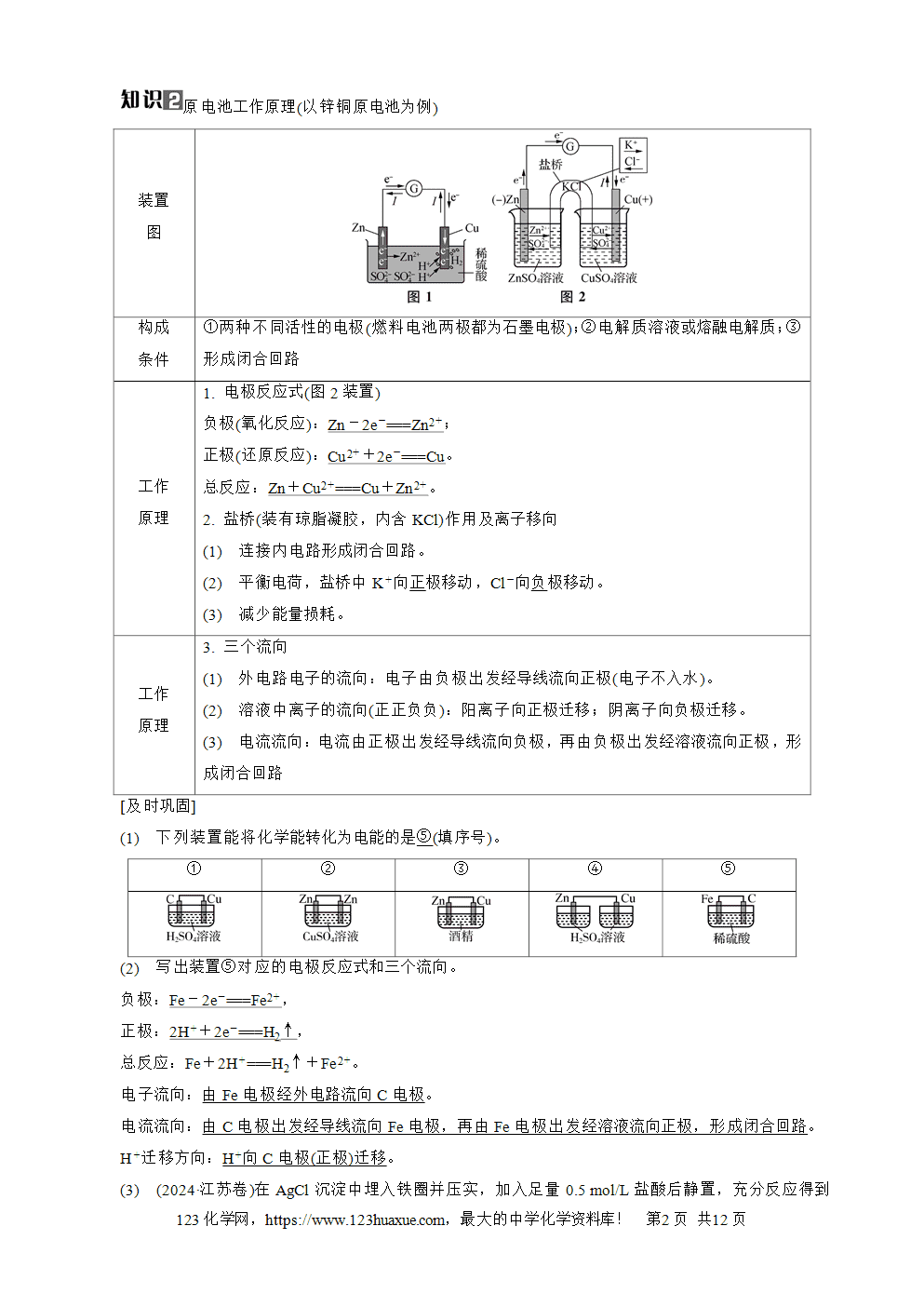




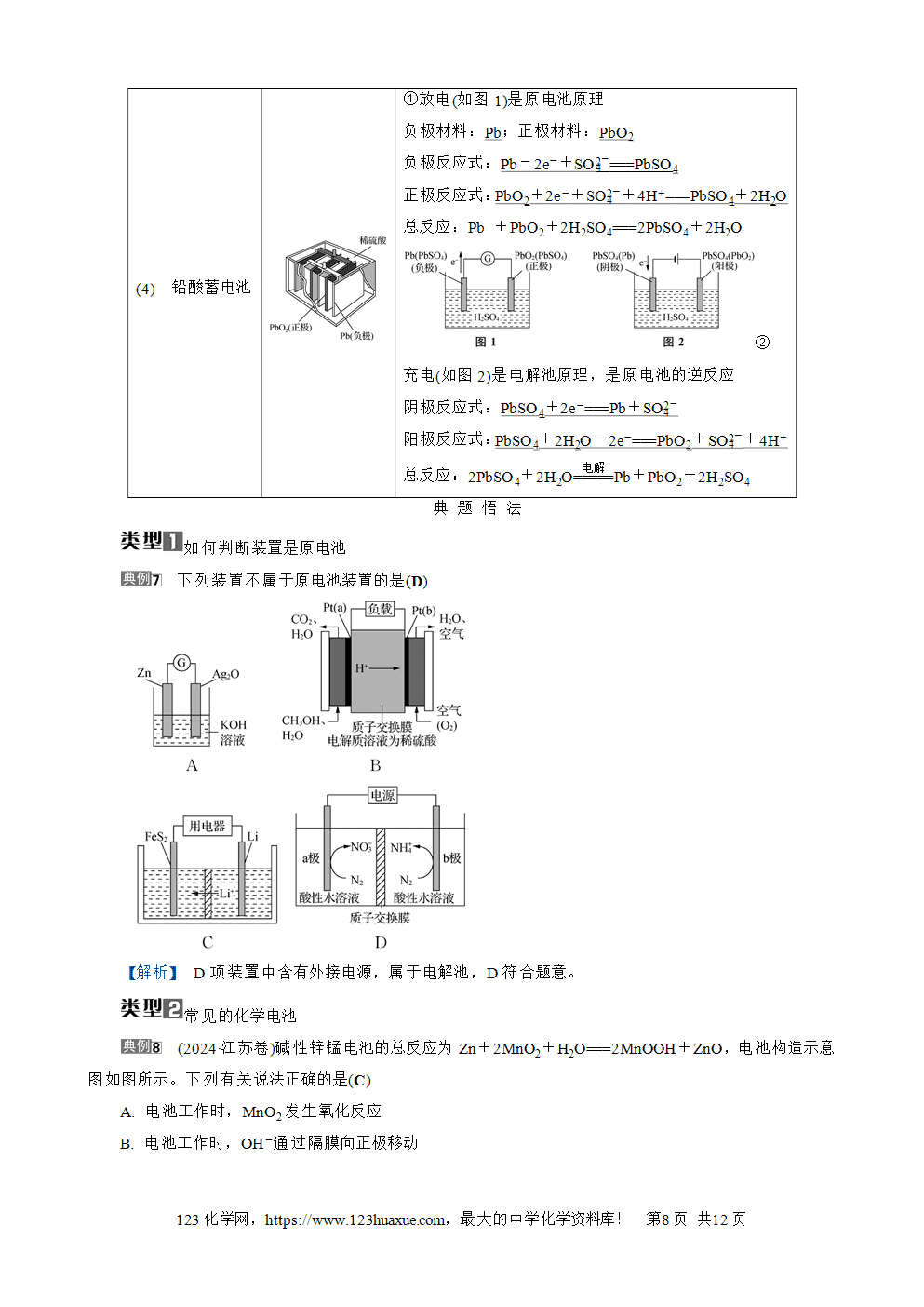

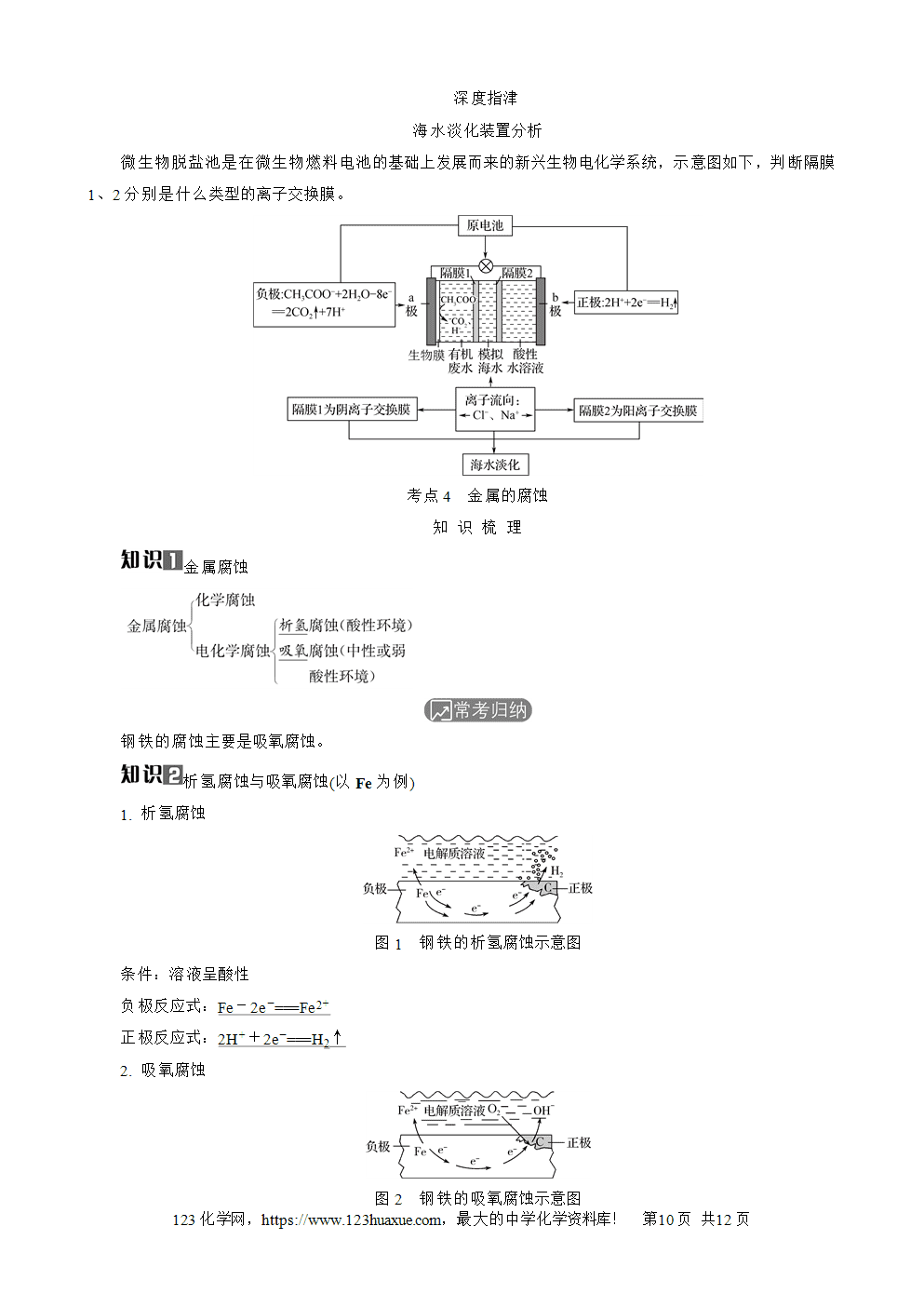

原电池正、负极的判断
1. 依据电子流向:电子由负极出发经导线流向正极(溶液中无电子流动)。
2. 依据电流流向:电流由正极出发经导线流向负极,正极的电势高,负极的电势低。
3. 依据离子迁移方向(正正负负):阳离子向正极迁移;阴离子向负极迁移。
4. 依据两极材料:一般活泼金属作负极,活动性较弱的金属或惰性电极作正极。
特例:Al-NaOH溶液-Mg原电池中,虽然Mg比Al活泼,但是Mg不与NaOH溶液反应,故Al作负极,Mg作正极。Fe(Al)-浓硝酸-Cu原电池中,虽然Fe、Al比Cu活泼,但是Fe、Al会在浓硝酸中钝化,故钝化后,Cu作负极,Fe或Al作正极。
5. 依据电极现象:一般,电极逐渐溶解的为负极,电极增重或有气体放出的为正极。
6. 依据电极反应:失去电子发生氧化反应的一极是负极,得到电子发生还原反应的一极是正极。
7. 依据电解质溶液:能与电解质溶液反应的一极作负极,不能与电解质溶液反应的一极作正极。
典 题 悟 法
原电池工作原理
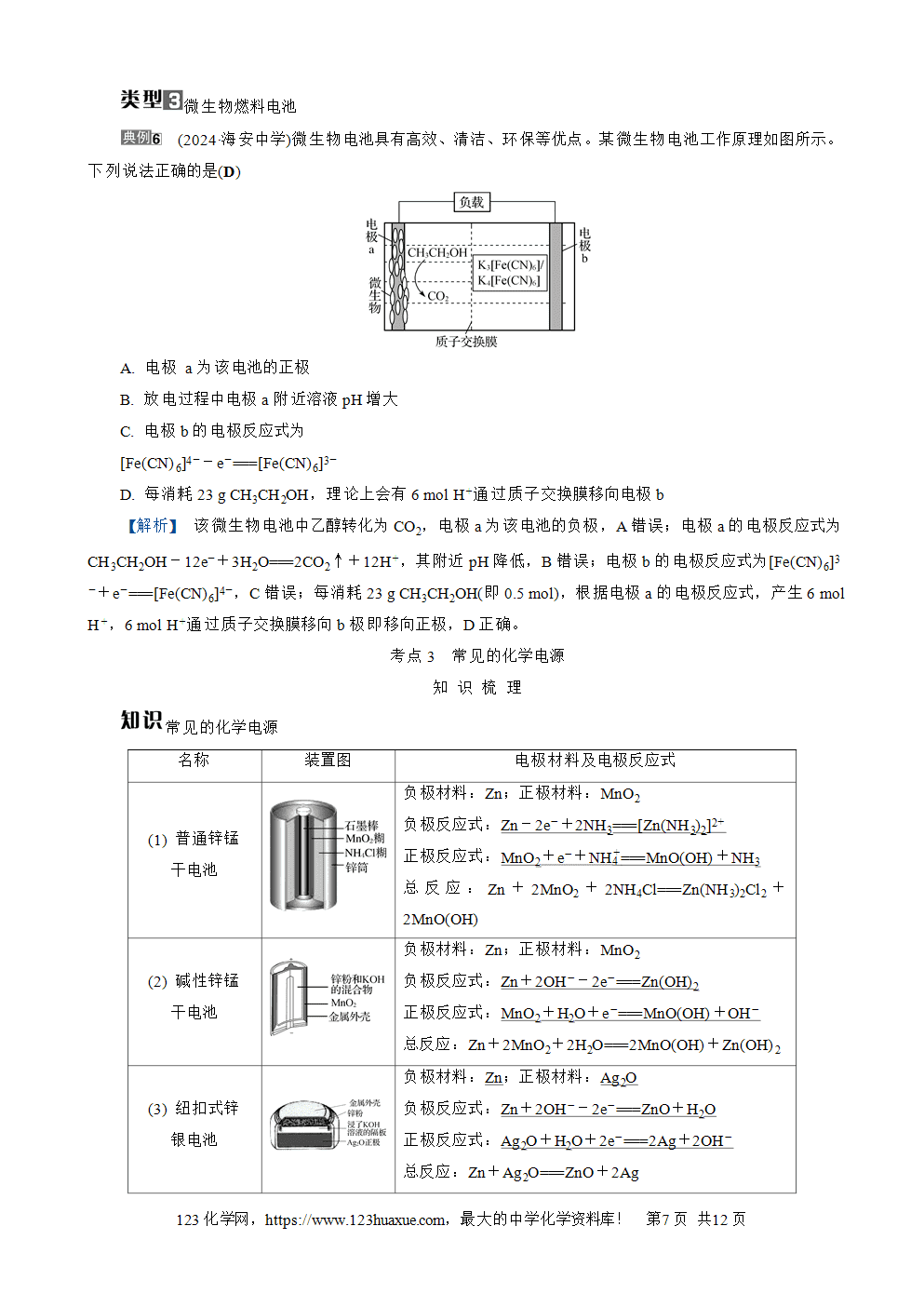
(2024·宝应中学)利用电化学原理消除污染,还可获得电能,一种处理垃圾渗透液的装置工作原理如图所示。下列说法错误的是(A)
A. X极的电极反应式为
2NH4(+)-6e-+6OH-===N2↑+6H2O
B. Y是正极,NO3(-)发生还原反应
C. 当电路中通过5 mol电子,正极区有14 g气体放出
D. 盐桥内Cl-移向X电极
【解析】 X电极上NH4(+)转化为N2,X电极为负极,负极反应式为2NH4(+)-6e-===N2↑+8H+,A错误;Y电极上NO3(-)转化为N2,NO3(-)发生还原反应,B正确;Y电极为正极,正极反应式为2NO3(-)+10e-+12H+===N2↑+6H2O,即每产生1 mol N2会转移10 mol电子,当电路中通过5 mol电子时正极区产生0.5 mol氮气,质量为14 g,C正确;阳离子移向正极,阴离子移向负极,即盐桥内Cl-移向X极,D正确。