
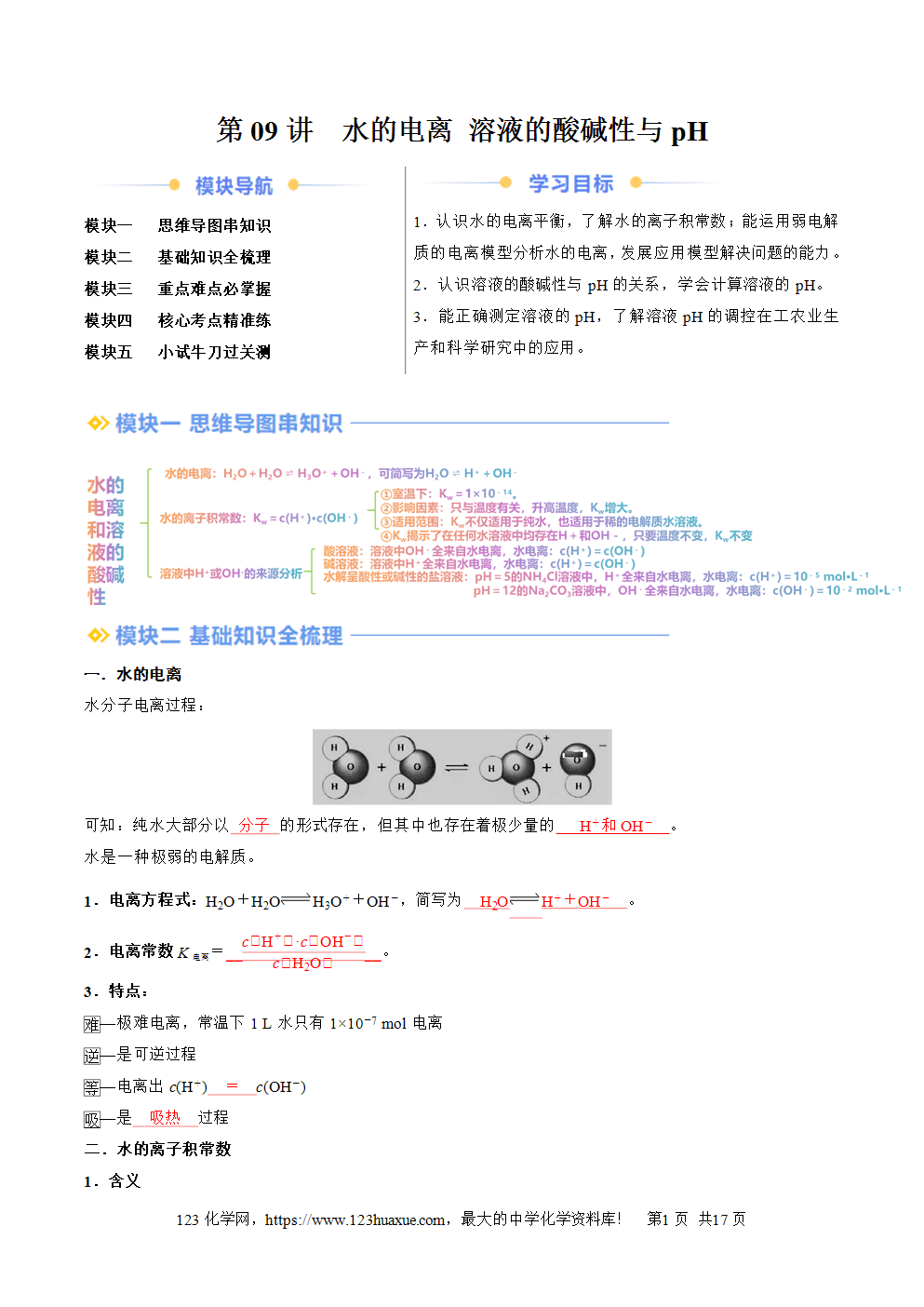














理解Kw应注意的几个问题:
(1)Kw揭示了在任何水溶液中均存在水的电离平衡,H+和OH-共存,只是相对含量不同而已。
(2)Kw只与温度有关。因为水的电离是吸热过程,所以温度升高,有利于水的电离,Kw增大,如100 ℃,Kw=5.5×10-13。但是在室温下,Kw为1.0×10-14。
(3)Kw不仅适用于纯水,还适用于酸、碱的稀溶液,且由水电离的c水(H+)=c水(OH-)。此时,水溶液中水的离子积常数不变。
二.溶液pH的计算
【问题探究】
1.常温时,pH=2的溶液与pH=12的溶液等体积混合后,混合液的pH一定等于7吗?
不一定。如果一种是强酸,另一种是强碱,则混合后呈中性,pH=7;如果一种是强酸,另一种是弱碱,则混合后碱过量,混合液呈碱性,pH>7;如果一种是弱酸,另一种是强碱,则混合后酸过量,混合液呈酸性,pH<7。
2.等体积pH都为13的NaOH和NH3·H2O溶液,加水稀释到pH都为12,所需水的体积一样多吗?
不一样多。因为NaOH为强碱,稀释时c(OH-)与溶液体积成反比,即稀释10倍就可以使pH从13变为12;而NH3·H2O为弱碱,在稀释时,随着水的加入,不仅使c(OH-)减小,而且影响氨水的电离平衡,从而使c(OH-)不是成倍数地减少,即氨水pH从13变为12,要稀释10倍以上。
【知识归纳总结】
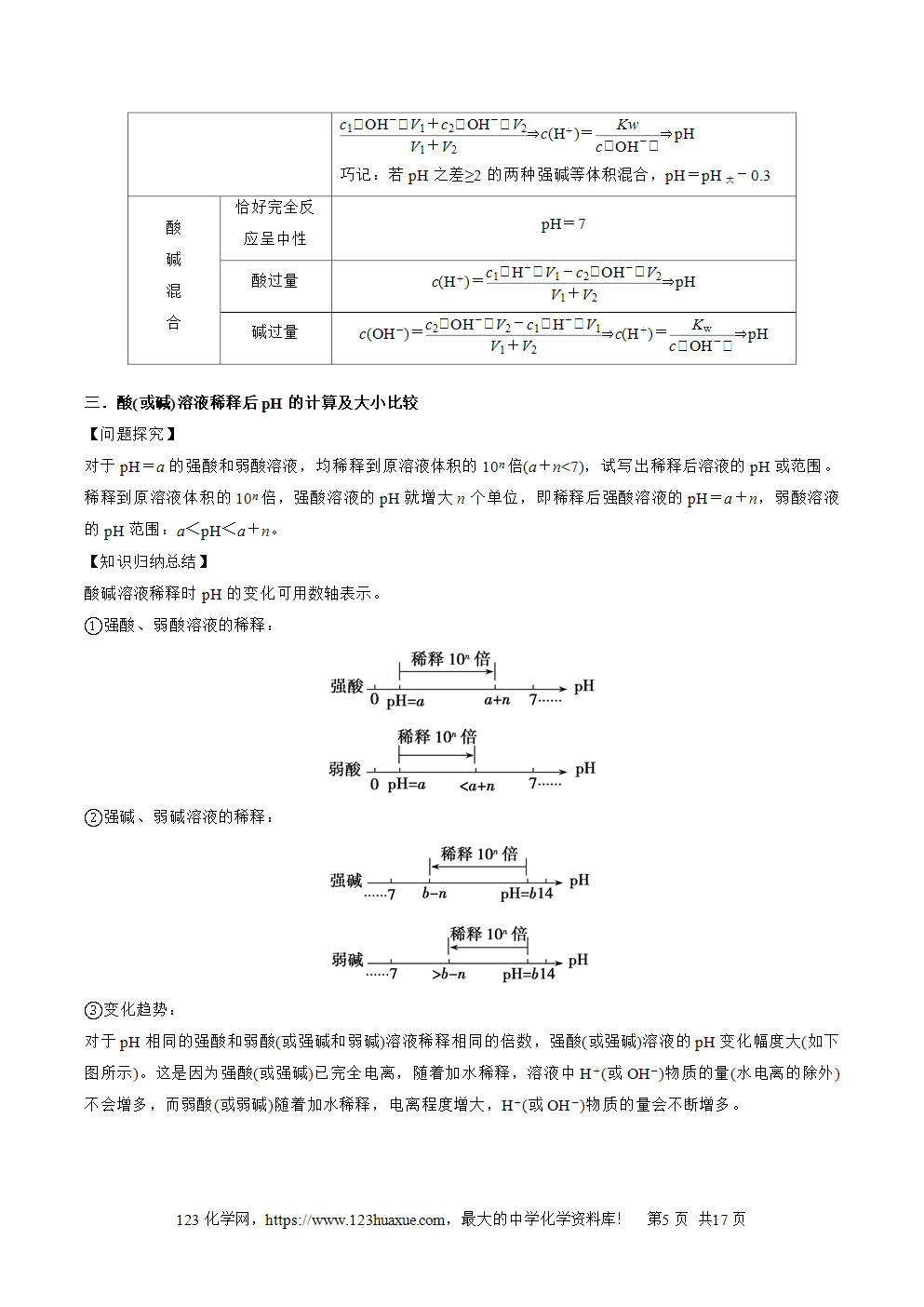
1.单一溶液的pH计算
①强酸溶液,如HnA,设物质的量浓度为c mol·L-1,c(H+)=nc mol·L-1,pH=-lg c(H+)=-lg nc。
②强碱溶液,如B(OH)n,设浓度为c mol·L-1,c(H+)=nc(10-14)mol·L-1,pH=-lg c(H+)=14+lg nc。