



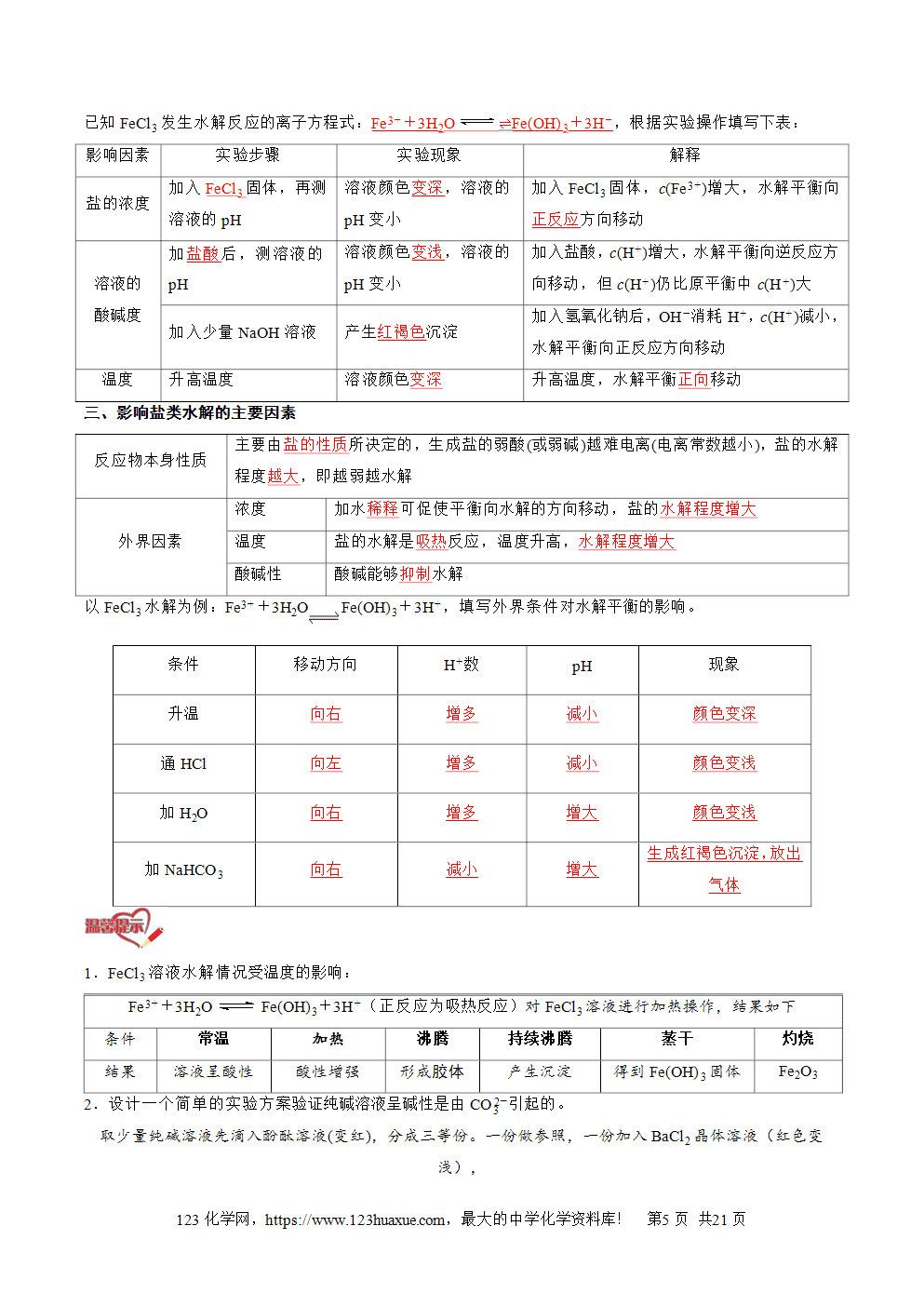

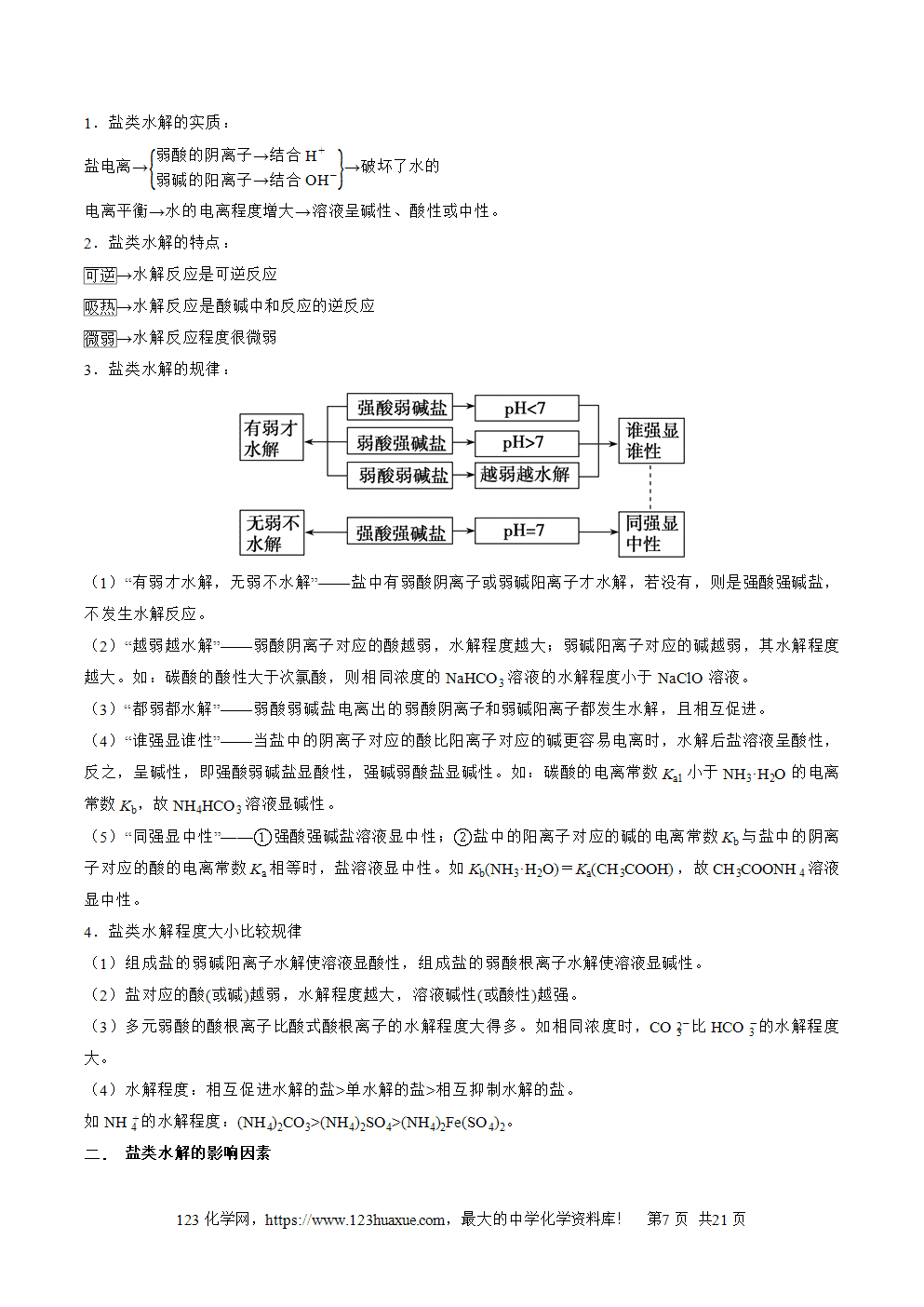











盐类水解的过程:
①电离:盐全部电离成自由移动离子,水微弱电离出H+和OH-。
②结合:离子之间通过有效碰撞后,生成难电离的分子或离子。
③移动:由于形成难电离的分子或离子,使溶液中的c(H+)或c(OH-)减少,改变原有的水的电离平衡。促使水的电离程度变大。
④显性:由于水的电离平衡被破坏,致使c(H+)、c(OH-)不相等,从而使溶液出现酸碱性。
弱酸的酸式盐其水溶液中显酸性或碱性?
将NaHCO3溶于水,加入酚酞试液,溶液呈浅红色。
解释:在NaHCO3溶液中存在两种平衡——电离平衡:HCO3-H++CO32-,溶液呈酸性;水解平衡:HCO3-+H2OH2CO3+OH-,溶液呈碱性。溶液的酸碱性取决于电离平衡与水解平衡的相对大小,由于HCO3-的水解趋势大于其电离趋势,所以NaHCO3溶液呈碱性。
酸式盐的水解:
①中强酸的酸式盐——以电离为主:呈酸性(如HSO3-)。
②弱酸的酸式盐——以水解为主:呈碱性(如HCO3-)。