
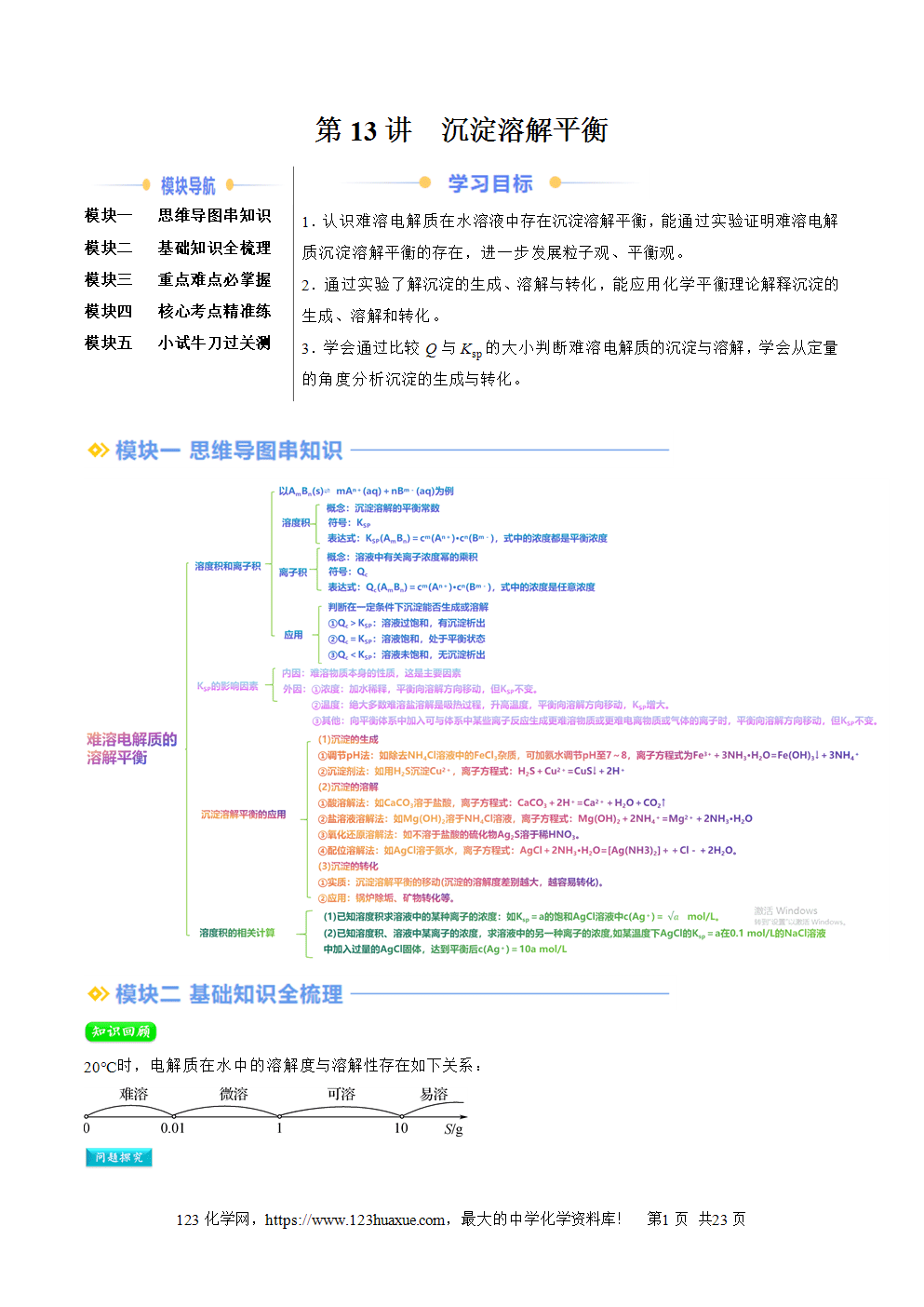


















20℃时,电解质在水中的溶解度与溶解性存在如下关系:
NaCl能不能和盐酸反应?
NaCl与HCl不发生反应。
在NaCl饱和溶液中,加入浓盐酸。
现象:产生白色沉淀。
解释:在饱和NaCl溶液中存在溶解平衡:NaCl(s)Na++Cl-,加入浓盐酸,增大了c(Cl-),平衡向左移动,从而析出NaCl。
可溶的电解质在溶液中存在溶解平衡,难溶电解质是否也存在溶解平衡呢?
用药匙取少量Mg(OH)2固体粉末放入小烧杯中加约30 mL蒸馏水搅拌,向悬浊液中滴加两滴酚酞试液。
现象:溶液变成红色。
解释:Mg(OH)2有少量溶解并电离出足以使酚酞变红的OH-,即悬浊液中存在以下平衡:Mg(OH)2(s)Mg2++(aq)+2OH-(aq)。
思考:
①请根据Mg(OH)2在水溶液中存在的下列可逆过程,叙述什么是沉淀溶解平衡状态?
Mg(OH)2(s)溶解沉淀Mg2+(aq)+2OH-(aq)
②沉淀溶解平衡有哪些特点?
③在一定温度下上述沉淀溶解平衡的平衡常数如何表达?
一.难溶电解质的沉淀溶解平衡
1.概念
在一定温度下,当难溶电解质在水中形成饱和溶液时,沉淀速率与溶解速率相等,达到平衡状态。
2.沉淀溶解平衡的建立
3.沉淀溶解平衡方程式
Mg(OH)2(s)Mg2++(aq)+2OH-(aq)
沉淀、溶解之间这种动态平衡也决定了Mg2+与OH-的反应不能完全进行到底。一般情况下,当溶液中剩余离子的浓度小于1×10-5mol·L-1时,化学上通常认为生成沉淀的反应进行完全了。