孤对的排斥力是“分子结构”模块重点的考察内容,我们这期重点讲一讲这个模块。
1. 为何孤对电子的排斥力更大?
简单来说,相比于键对电子,孤对电子距离原子核更近,所以产生的排斥力更大。
比如说,SO3中S-O的成键电子对位于两个原子之间,同时受到S、O原子的牵制(实际上距离O原子更近),而SO2中的孤对电子只属于S原子自身。因此SO2中的孤对电子距离S原子核更近,排斥力更大。
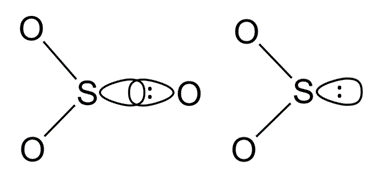
孤对电子的排斥力更大会造成许多深远的影响,也是后续结构化学中有趣现象的基础。
2. 影响分子构型
孤对电子的排斥力更大,如果在中心原子上有孤对电子,那就有如“大爷”一般的存在。孤对电子必须优先安排在空间位阻最小的位置,再去安排其他的成键原子。
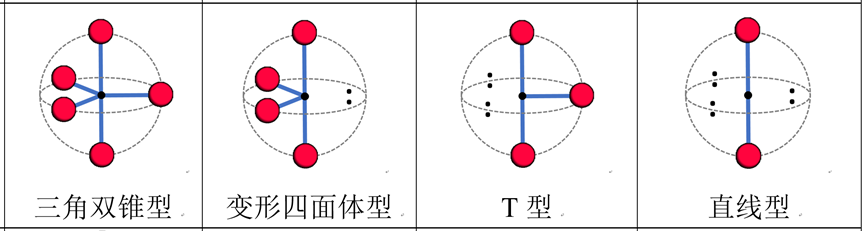
以sp3d的五配位结构为例,由于“赤道位”(图中横圈的三个位置)的空间位阻更小、“两极位”(图中垂直上下的两个位置)的空间位阻更大,因此如果有孤对电子的话,孤对电子都会被安排进入“赤道位”。
3. 影响键角
孤对电子对成键电子对的排斥力最大,因此具有孤对电子的分子键角会略小于等性杂化时的键角。
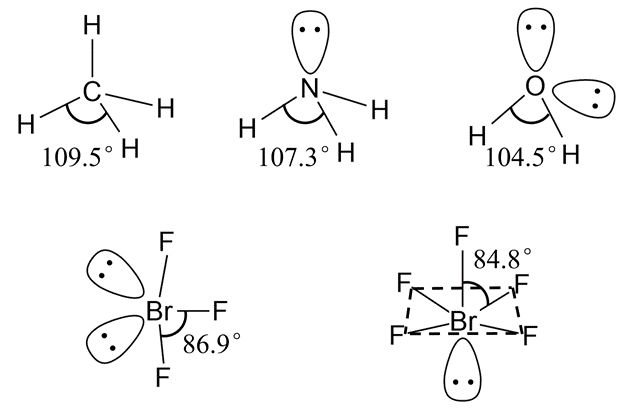
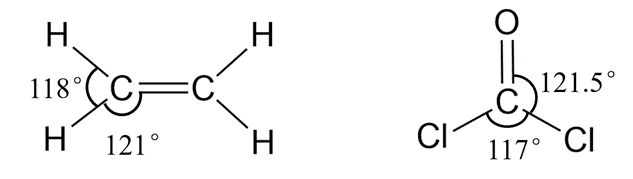
CH4、NH3、H2O中的键角分别为109.5°、107.3°、104.5°,键角依次减小。类似地,BrF3、BrF5的中心原子位置略微向外突出而偏离标准的T形或四方锥型。
4. 多重键的排斥作用
多重键(双键、三键)与孤对电子具有相似性。排斥力的顺序符合:孤对电子> 多重键> 单键。因此多重键堪称“二大爷”一般的存在,地位仅次于孤对电子,并且在没有孤对电子的情况下称王称霸。
比如说,在分子构型中,要先给“大爷”——孤对电子留空间位阻比较小的好地方。伺候完“大爷”,接着就要伺候“二大爷”——多重键,它要占其余空间位阻比较小的好地方。所以说,SOF4、XeOF2的形状是这样的:

另外,含有多重键的键角也会因为排斥力略微大一丢丢……
5. 不在同一个原子上的电子对
孤对-孤对之间的排斥是如此的大,以至于即使在不同原子之间仍然能够体现。下面我们举几个例子:
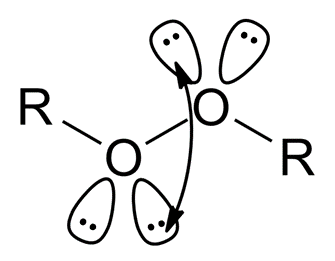
①通常认为π键键能小于σ键,因此单键键能应大于双键的一半,但O-O单键键能(146kJ/mol)反常地小于O=O键能(496kJ/mol)的一半,这是由于两个相邻O原子的孤对电子之间具有强烈的相互排斥作用。
②类似地,N2H4(肼)中的N-N 键长大于N2H62+中的N-N 键长,尽管后者具有两个N原子均为正电荷的排斥因素。这是由于N2H4中两个N原子上均有孤对电子,孤对电子之间的斥力大于N2H62+中正电荷之间的斥力,从而将N-N键拉长。
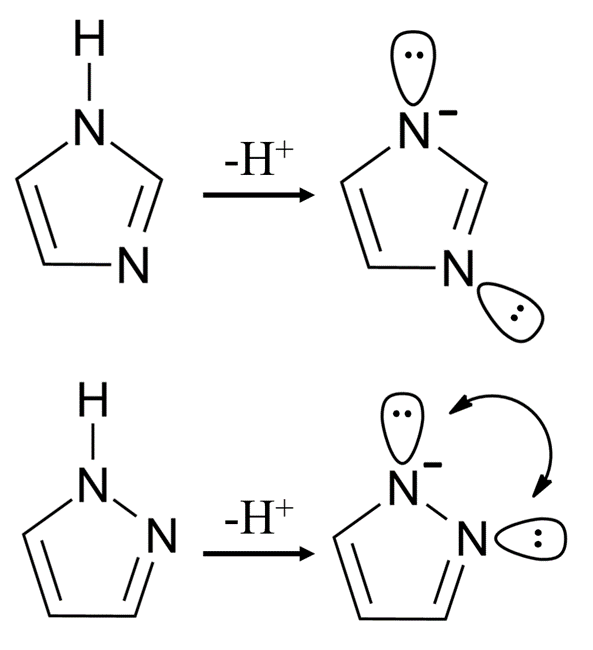
③咪唑(上图)的酸性强于异咪唑(下图),这是由于异咪唑电离后产生的孤对电子与邻位N上的孤对具有强烈的排斥作用,降低了其稳定性。这个效应在有机化学中被称为“α效应”类似地,吡啶的α氢酸性也弱于γ氢。
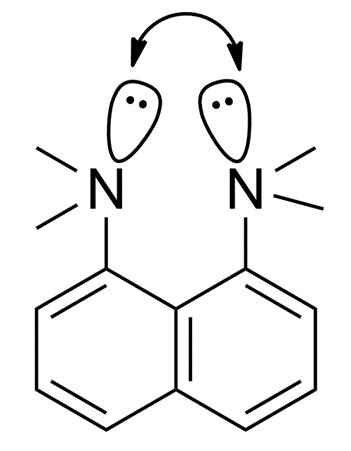
④N,N,N',N'-四甲基-1,8-萘二胺具有很强的碱性,这是也是由于两个N原子孤对电子之间的排斥力,它不好。从原子连接顺序来说,这两个氮原子相隔较远(相隔3个原子),但从空间上说,它们距离却非常近。