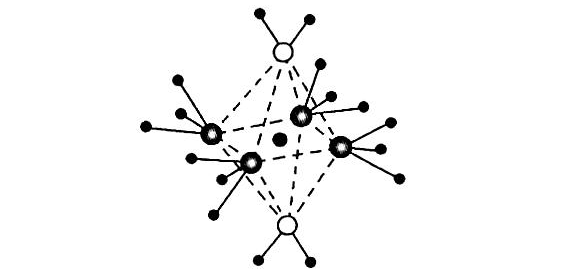
【导读】四氨合铜离子[Cu(NH₃)₄]²⁺是一种典型的过渡金属配合物,要解释其独特的平面正方形结构,需要结合价键理论、晶体场理论及现代计算化学方法,从多角度方可理清其结构成因与稳定性机制。
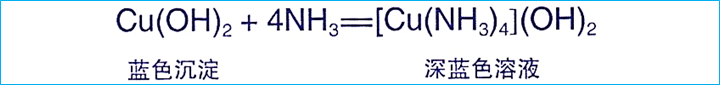
四氨合铜离子的平面正方形结构是姜-泰勒效应导致八面体畸变的结果,其本质是中心离子3d轨道电子的不对称分布与配体相互作用的能量平衡。通过晶体场理论和DFT计算补充完善了价键理论的局限性,从而解释了Cu(NH₃)₄(H₂O)₂]²⁺从八面体畸变到[Cu(NH₃)₄]²⁺平面正方形的结构演化机制。(此文有点晦涩,笔者未实现将此文转化成通俗易读的科普小文.)
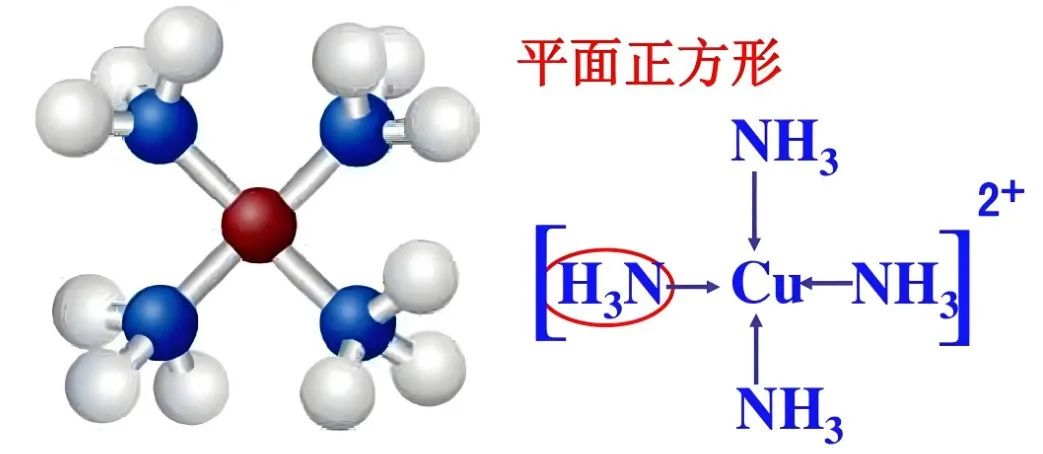
一、中心离子的电子构型与价键理论的局限性
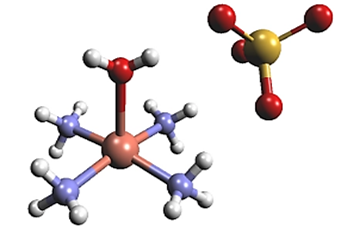
Cu²⁺的价层电子排布为3d⁹,当与NH₃配位时,早期价键理论认为中心离子可能采取dsp²杂化(部分教材定为dsp²杂化,这不是教材偏误,而是简化知识后的妥协),形成平面正方形结构。该理论假设3d轨道中的单电子激发到4p轨道,这会导致配合物具有较强的还原性,与[Cu(NH₃)₄]²⁺在溶液中稳定存在的实验现象不符,说明价键理论无法很合理的解释其结构稳定性,需借助晶体场理论进一步分析。
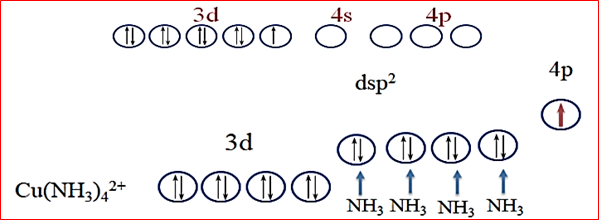
二、晶体场理论与姜-泰勒(Jahn-Teller)效应的关键作用
根据晶体场理论,Cu²⁺在八面体场中d轨道分裂为t₂g(dxy、dyz、dxz)和eg(dz²、dx²-y²)轨道。由于d⁹电子构型在eg轨道上的电子分布不对称(t₂g⁶eg³),会引发Jahn-Teller效应—配体的空间排布因电子云不对称而畸变,以降低体系能量。
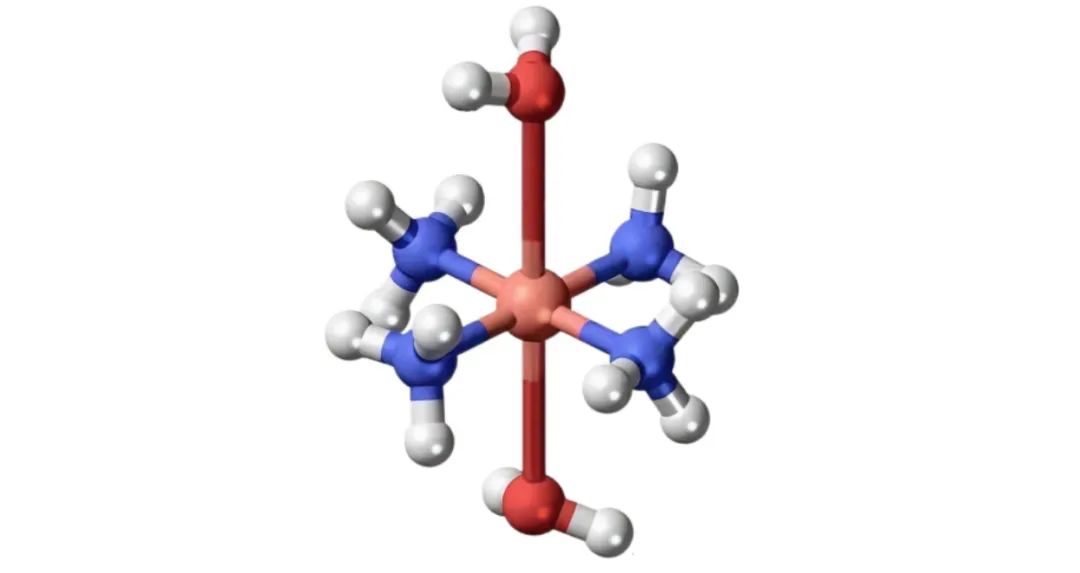
对于[Cu(NH₃)₄]²⁺,若考虑在水溶液中水分子作为第五和第六配体([Cu(NH₃)₄(H₂O)₂]²⁺),其初始八面体结构中,eg轨道上的3个电子更可能排布为(dz²)¹(dx²-y²)²,导致z轴方向配体(H₂O)与Cu²⁺的作用减弱,键长拉长(Cu-O键长可达307pm以上),而xy平面上的4个NH₃分子与Cu²⁺形成较短且稳定的配位键(Cu-N键长约205pm)。当长轴方向的配体因键长过长而被忽略时,配合物呈现平面正方形构型,配位数可视为4。这种畸变使体系能量降低,符合实验观测到的稳定性。
三、计算化学对结构与稳定性的验证
密度泛函理论(DFT)计算表明,四氨合铜离子在水溶液中更倾向于形成六配位的拉长八面体结构([Cu(NH₃)₄(H₂O)₂]²⁺),但长轴上的水分子与Cu²⁺的键长(224-395pm)显著大于平面内的Cu-N键(202-208pm),导致其实际配位作用较弱。通过吉布斯自由能计算发现,四氨合铜离子的平面正方形结构(忽略长轴配体)能量最低,稳定性最高,而五氨合铜离子和六氨合铜离子因配体间库仑斥力增大,能量显著升高,仅能在特定条件(如液氨环境)下存在。
实验测定的Cu-N键长(约207pm)与B3LYP/def2-TZVP基组计算结果(205.6pm)高度吻合,进一步支持了平面正方形结构的合理性。此外,反式 [Cu(NH₃)₄(H₂O)₂]²⁺的稳定性高于顺式构型,与分子对称性及偶极矩效应一致,表明配位场理论与计算化学的结合能更精准地解释结构细节。
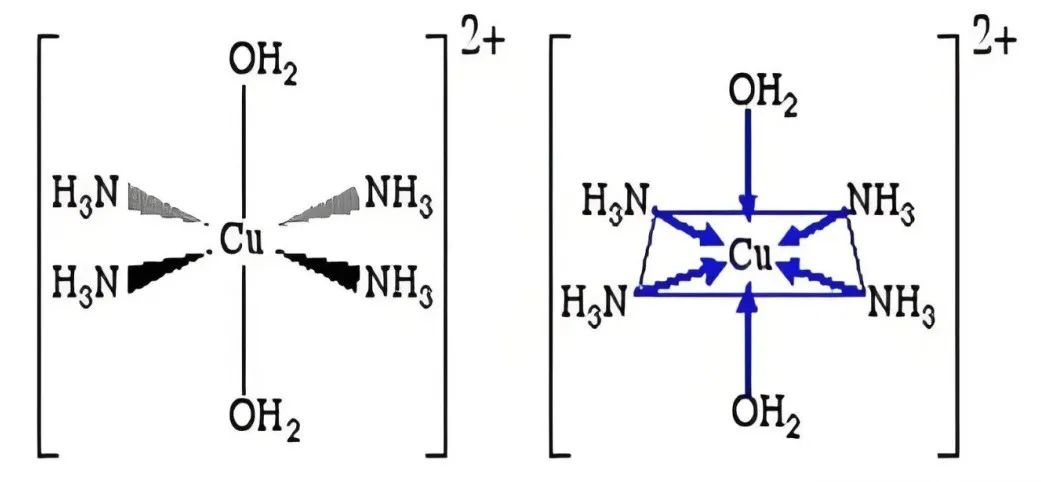
四、结构与性质稳定性的关联
[Cu(NH₃)₄]²⁺的平面正方形结构使其具有独特的光谱和磁学性质。如d-d跃迁吸收光谱对应平面内dx²-y²与dz²轨道的能量差,而顺磁性源于未成对电子的存在。在溶液中,该结构的稳定性使其成为铜离子配位滴定和定性分析的重要物种,如氨性溶液中Cu²⁺的深蓝色显色反应即与形成[Cu(NH₃)₄]²⁺相关。
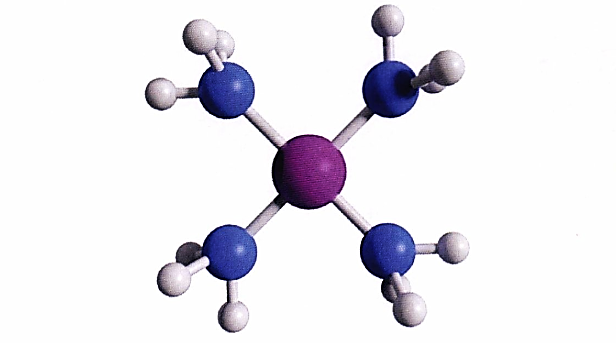
姜-泰勒(Jahn-Teller)效应:在非线性分子中,电子非对称地占据简并分子轨道,导致分子几何构型发生畸变从而退简并的现象。这种畸变会降低分子的对称性与轨道简并度,使体系能量下降。该效应常见于金属配合物,但无法预测畸变方向,仅能表明存在不稳定构型。Zn²⁺的3d轨道全满,没有姜-泰勒效应,没有畸形的八面体结构,Zn²⁺是sp³杂化,所以[Zn(NH₃)₄]²⁺是正四面体。
姜-泰勒(Jahn-Teller)定理:从本质上指出,任何具有空间简并电子基态的非线性分子,都会通过几何变形消除简并性,因这种变形可降低体系整体能量。即对称的非线性分子不能处于简并态,分子会发生 “姜-泰勒畸变”,使原本能量相同的波函数获得不同能量,其中最低能量态为非简并态且低于未畸变分子的能量。这是对分子在简并态下行为的理论预测,解释了非线性分子特定电子构型下构型变化的必然性。