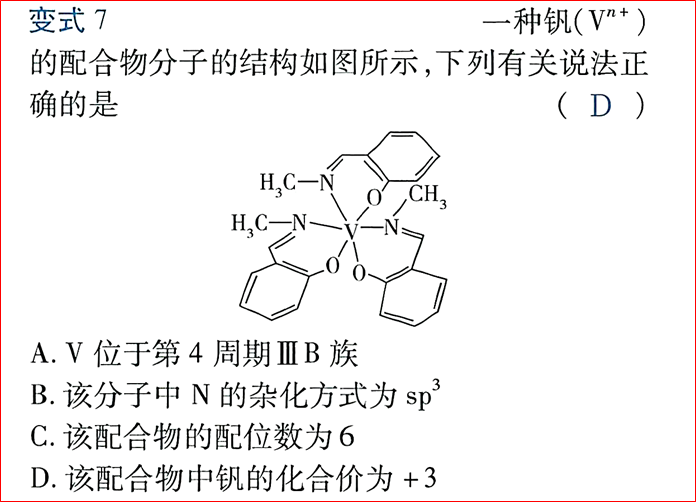
标题疑问的答案都是否定的,均不一定是等号关系。
配体数:是指与中心原子结合的配体总数。配位数:一般情况下配位数是配位原子总数,从配合物的配位键本质考虑,徐光宪先生给出了配位数更普遍的定义:配位数是配体在与中心原子形成配合物时,向中心原子提供的电子对的数目。单齿配体配位数计算:配位数=配体数。例如NH₃做配体时,[Cu(NH₃)₄]²⁺的配位数和配体数均为4。多齿配体配位数计算:配位数≠配体数。例如乙二胺en做配体时,[Cu(en)₂]²⁺中,配体数=2(en为双齿),配位数=2×2=4。二、配位数与配位原子数的关系:配位数=配位原子数(一般情况下)
配位数:直接由与中心原子成键的配位原子总数决定。例如:[Fe(CN)₆]⁴⁻中,每个CN⁻提供1个配位原子(C),配位数=6。[Co(NH₃)₂(H₂O)₄]Cl中,NH₃的N原子和H₂O的O原子共6个配位原子,配位数=6。
单齿配体配位数的计算:配位数=配体数,例如[Ag(NH₃)₂]⁺的配位数=2。
多齿配体配位数的计算:配位数=配体数×齿数,例如[Fe(EDTA)]⁻(EDTA为六齿)的配位数=1×6=6。
混合配体配位数的计算:分别计算后求和,例如[ZnCl₂(en)]中Cl⁻(单齿)和en(双齿)的配位数=2×1+1×2=4。
【提醒】“配位数=配体数×齿数”的适用条件是仅当所有配体为同类型多齿配体时成立,如[Cu(en)₂]²⁺,配体数=2,齿数=2,则配位数=2×2=4。而混合配体或不同齿数的配体需单独计算,不可直接套用公式。
概念 | 规则与示例 |
配位数与配体数 | 单齿时相等,多齿时不等([Cu(en)₂]²⁺配位数=4) |
配位数与配位原子 | 一般情况下相等(如[Fe(CN)₆]⁴⁻配位数=6) |
二茂铁配位数 | 6(基于配位键的本质定义) |
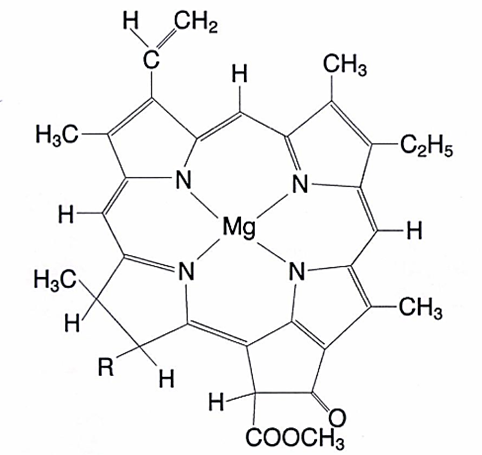
PS1:二茂铁的配位数为什么是6?
二茂铁结构:中心二价铁离子夹在两个环戊二烯基(Cp⁻)之间。
配位电子对分析:每个Cp⁻中5个碳各有1个电子,共5个电子,再加上Cp⁻自身所带的1个负电荷,相当于每个Cp⁻提供6个电子,即3对电子,两个Cp⁻共提供6对电子与中心二价铁离子配位,根据徐光宪先生提出配位数是配体向中心原子提供的电子对数目的定义,确定配位数是2×3=6。
这个典型的例子就说明了:配位数不一定等于配位原子数,即配位数≠配位原子数(不一定相等),配位数=配体向中心原子提供的电子对数。
常见配体 | NH₃ (氨) | H₂O (水) | CN⁻ (氰根) | SCN⁻ (硫氰根) | CO (羰基) |
配位原子 | N | O | C(多数) | S或N | C |
PS2:配合物中配位原子就是和中心原子直接成键的原子吗?
当然不是,这个先要理清配位原子的概念,再做辨析。
一:配位原子的定义
配位原子是指配位化合物中,一般情况下配体分子或离子内直接与中心原子(或中心离子)键合,并且是提供孤对电子的原子。
如:[Cu(NH₃)₄]²⁺中,NH₃的N原子与Cu²⁺结合,N为配位原子。[CoCl(NH₃)₃(H₂O)₂]SO₄中,Cl⁻的Cl原子、NH₃的N原子和H₂O的O原子均为配位原子。
二:配位原子常见的特征
1:配位原子必须具有孤对电子,能够通过配位键与中心原子结合。
2:常见元素类型
主要为周期表第ⅤA(N、P)、ⅥA(O、S)、ⅦA族(F、Cl、Br、I)元素,以及碳(C)和负氢离子(H⁻)。
3:位置判断
单齿配体中仅含1个配位原子(如NH₃的N、H₂O的O)。多齿配体可含多个配位原子(如乙二胺中的两个N原子)。
4:配位原子的判断
若配体为分子(如NH₃、H₂O),需识别其孤对电子所在的原子(如N、O)。若配体为离子(如CN⁻、SCN⁻),需确定其实际键合原子(如CN⁻中的C、SCN⁻中的S或N)。
5:特例说明
CO:配位原子为C(C提供孤对电子与金属结合)。
EDTA:多齿配体,配位原子为4个O和2个N。
三:由此,配位原子数≠与中心原子直接成键的原子数(不一定相等),配位原子数=与中心原子直接成键且是形成配位键的原子数(或者提供孤电子对的原子数)。