水电离曲线(图像9秒杀)-2025年高考化学选择压轴题图像专项突破秒杀技巧及专项练习
(解析版)
水电离曲线秒杀思想
模型:常温下,向20mL0.1mol·L-1 MOH溶液中滴加盐酸,溶液中由水电离出的c(H+)随加入盐酸体积的变化如图所示
基础:影响水的电离平衡的因素:
①外加酸、碱或强酸的酸式盐抑制水的电离
②盐类水解促进水的电离
关键点分析
①a点:由水电离出的c(H+)水=10-11mol·L-1,可知0.1mol·L-1 MOH溶液中c(OH-)=
10-3mol·L-1,推出MOH为弱碱,并可以求出其电离常数
②盐酸滴入MOH溶液过程中,溶质由MOHMOH和MClMClMCl和HCl,在这个过程中水的电离程度最大应该是MCl,可知c点应为MCl,那么b点应为MOH和MCl,d点应为MCl和HCl;因此b点为中性,d点不为中性,为酸性
经典模型1:常温下,向20mL0.1mol·L-1氨水中滴加等浓度的稀盐酸,溶液中由水电离出的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是
A.常温下,NH3·H2O的电离常数Kb约为1×10-5
B.c点所对应的盐酸体积为20mL
C.b、d两点溶液均为中性
D.b点后溶液中均存在c()<c(Cl-)
破解:A.由图可知,0.1mol·L-1氨水中由水电离出的氢离子浓度为10-11 mol·L-1,氨水抑制水的电离,则溶液中的c()=c(OH-)=10-3 mol·L-1,Kb==1×10-5,故A正确;
B.c点水的电离程度最大,溶液中的溶质只有NH4Cl,说明氨水和盐酸恰好完全反应,则所对应的盐酸体积为20mL,故B正确;
C.b点溶液中有NH3·H2O和NH4Cl呈中性,d点溶液中有NH4Cl和HCl,呈酸性,故C错误;
D.b点溶液中有NH3·H2O和NH4Cl呈中性,根据溶液中电荷守恒:,溶液呈中性,则,b点后又滴入盐酸,c(Cl-)增大,则存在c()<c(Cl-),故D正确;
答案选C。
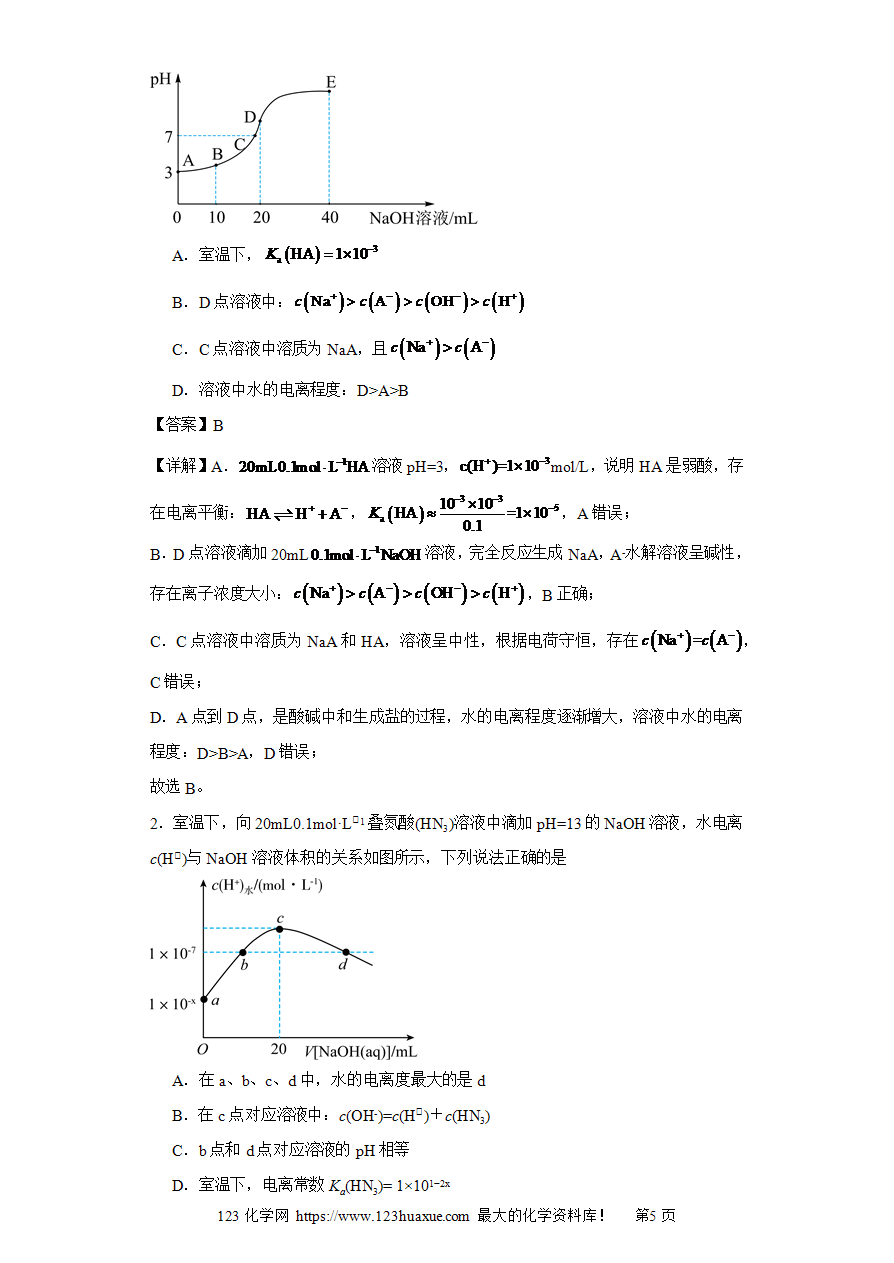
经典模型2:常温下,往溶液中滴加溶液,所得混合溶液中水电离的浓度和所加溶液体积变化趋势如图所示,下列有关说法正确的是