



















专题19 科学探究题
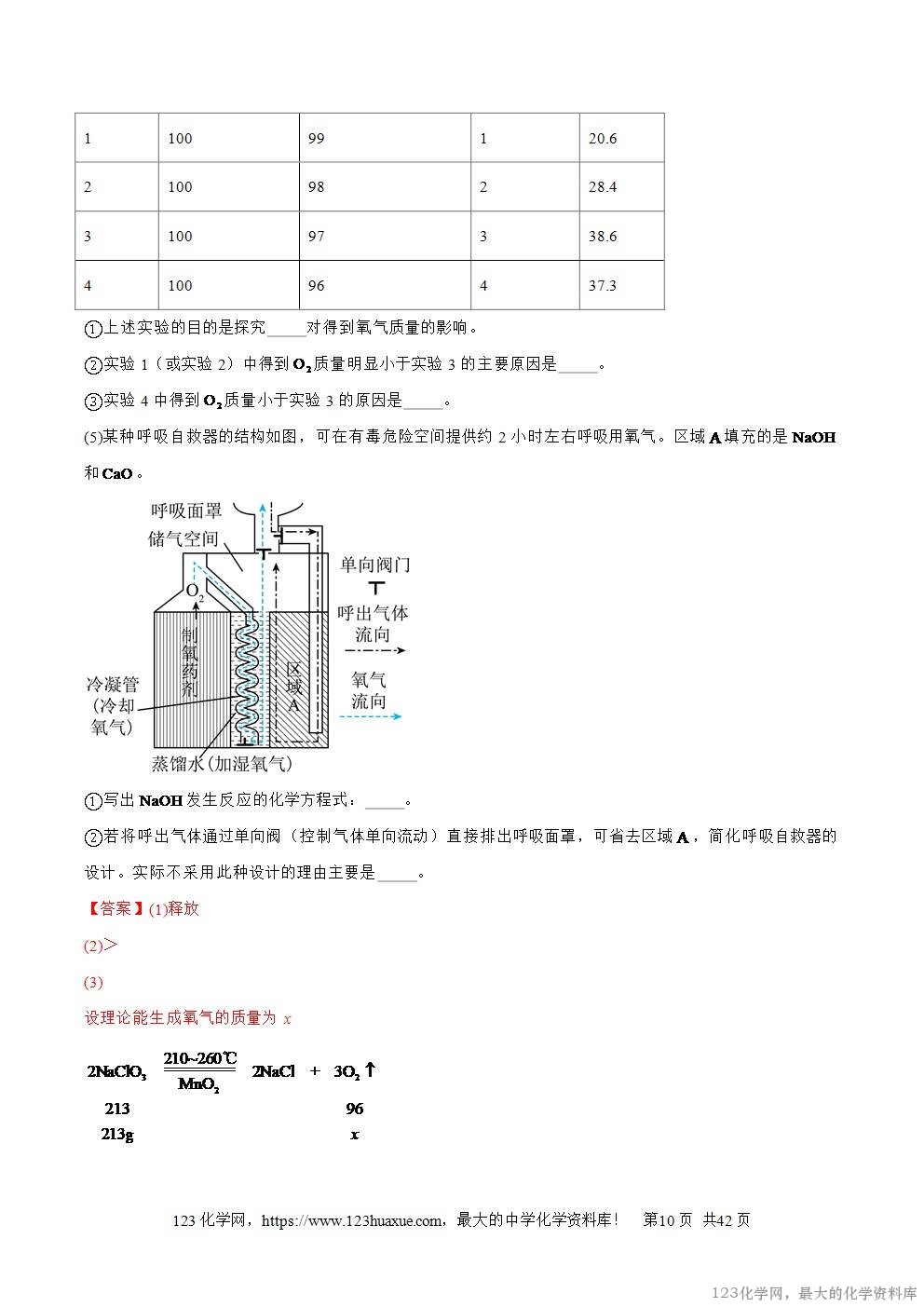
1.(2025·云南省)为探究硫燃烧产物的性质,利用如图所示装置进行实验。
(1)实验室用过氧化氢溶液制取氧气,该反应的化学方程式为 。
在集满氧气的三颈烧瓶中(夹持装置省略),加入少量紫色石蕊溶液,塞紧带电热棒和燃烧匙的双孔塞,关闭止水夹,引燃足量硫粉,充分反应。
资料卡片
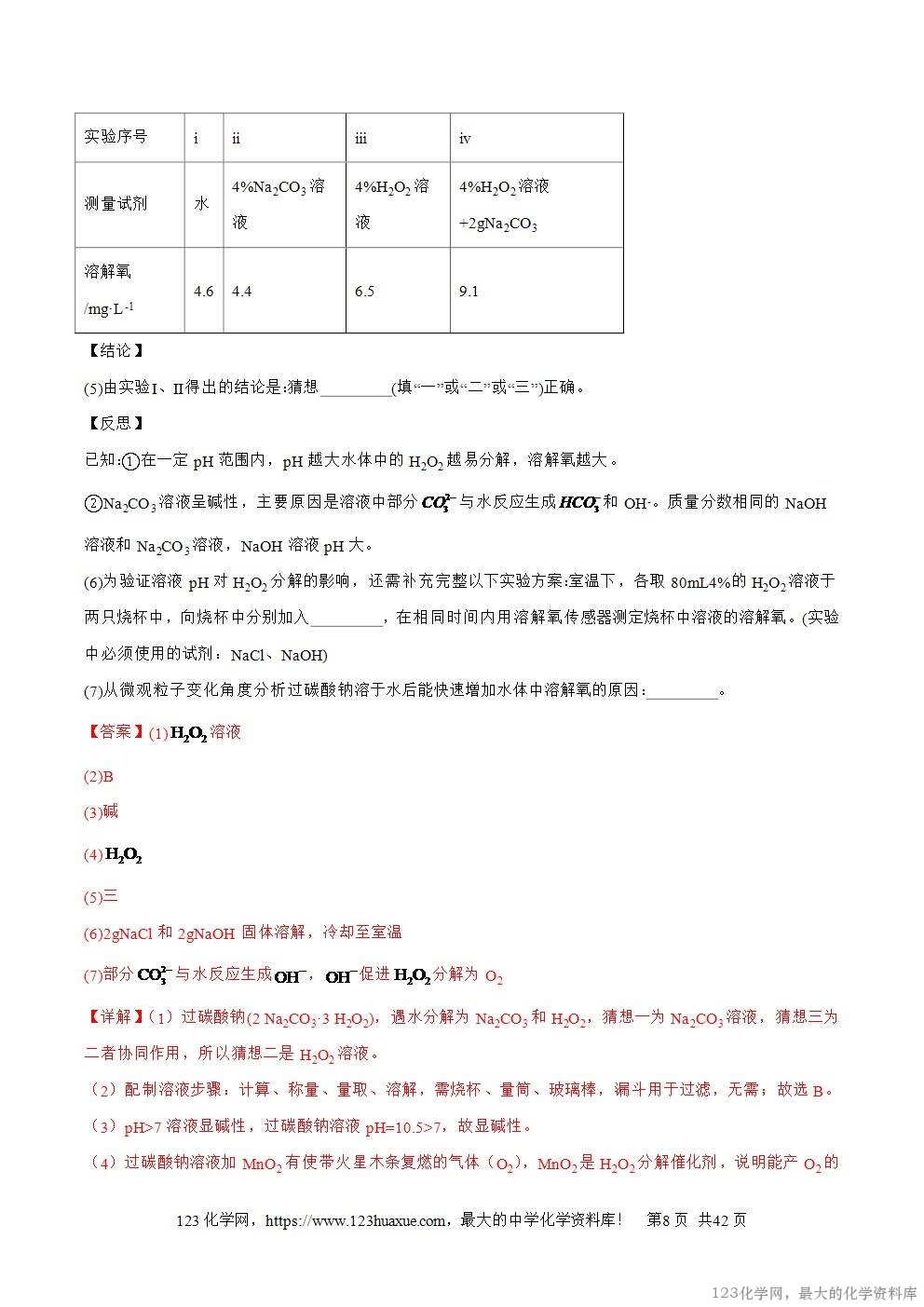
I.通常状况下,1体积水约能溶解40体积SO2;
II.SO2与CO2的化学性质相似。
(2)气球的作用是 。
(3)燃烧结束,待装置冷却至室温,振荡烧瓶,紫色石蕊溶液变为 色。打开止水夹,烧杯中可观察到的现象是 。
【答案】(1)2H2O22H2O+O2↑
(2)平衡瓶内压强
(3) 红 烧杯中的NaOH倒吸入三颈烧瓶
【详解】(1)过氧化氢在二氧化锰催化下生成氧气和水,化学方程式为:2H2O22H2O+O2↑;
(2)因为硫粉燃烧放热生成二氧化硫气体,故瓶内气压升高,气球是为了平衡瓶内压强,防止装置炸裂;
(3)因为二氧化硫和二氧化碳的化学性质相似,故二氧化硫也能和水反应生成显酸性的物质,故紫色石蕊溶液变为红色;因为生成的二氧化硫和水反应,恢复至常温后瓶内压强降低,故打开止水夹,烧杯中的NaOH倒吸入三颈烧瓶。
2.(2025·安徽省)学习了“常见的酸、碱、盐”后,某化学兴趣小组为探究和的性质,设计并进行了如下实验。
【实验一】探究固体的稳定性
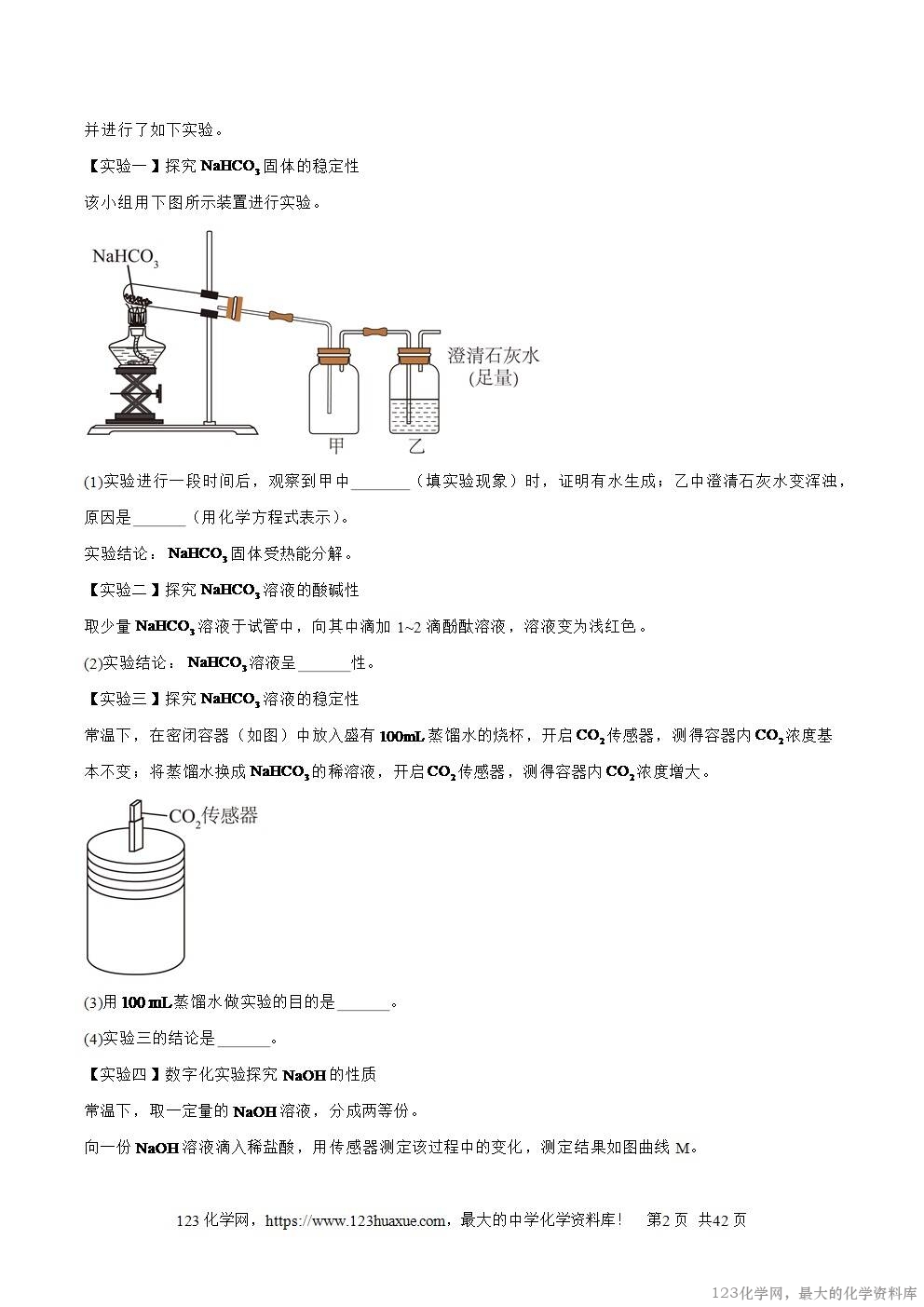
该小组用下图所示装置进行实验。
(1)实验进行一段时间后,观察到甲中 (填实验现象)时,证明有水生成;乙中澄清石灰水变浑浊,原因是 (用化学方程式表示)。
实验结论:固体受热能分解。
【实验二】探究溶液的酸碱性
取少量溶液于试管中,向其中滴加1~2滴酚酞溶液,溶液变为浅红色。
(2)实验结论:溶液呈 性。
【实验三】探究溶液的稳定性
常温下,在密闭容器(如图)中放入盛有蒸馏水的烧杯,开启传感器,测得容器内浓度基本不变;将蒸馏水换成的稀溶液,开启传感器,测得容器内浓度增大。
(3)用蒸馏水做实验的目的是 。
(4)实验三的结论是 。
【实验四】数字化实验探究的性质
常温下,取一定量的溶液,分成两等份。
向一份溶液滴入稀盐酸,用传感器测定该过程中的变化,测定结果如图曲线M。
向另一份溶液先通入一定量的,充分反应后得到溶液X。再向溶液X中滴入相同质量分数的稀盐酸,同时用传感器测定变化,得到随盐酸体积()变化曲线N(未在下图坐标系中画出)。
(5)溶液X的 (填“大于”“小于”或“等于”)A点的。
(6)曲线N上横坐标为10时,对应溶液中的溶质是 (填化学式)。
【答案】(1) 出现无色液滴
(2)碱
(3)作对照实验或空白实验
(4)常温下,溶液不稳定,能产生
(5)小于
(6)、(合理答案均可)
【详解】(1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,甲中观察到有白雾产生,则证明有水生成;
二氧化碳和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:。
(2)酚酞溶液遇碱性溶液变红色,则说明碳酸氢钠溶液呈碱性。
(3)二氧化碳能溶于水,且能和水反应,则用100mL蒸馏水做实验的目的为作对照实验或空白实验。
(4)加入碳酸氢钠溶液后,二氧化碳浓度增大,说明常温下碳酸氢钠不稳定,能产生二氧化碳。
(5)由于氢氧化钠和二氧化碳能反应生成碳酸钠和水,则溶液的碱性会减弱,故溶液X的pH小于A点的pH。
(6)由于,横坐标为10时,M曲线的溶液pH=7,说明此时氢氧化钠和盐酸恰好反应,溶液中的溶质为氯化钠,钠离子和氯离子个数比为1:1,而曲线N中,,即使氢氧化钠有剩余,由于,当横坐标为10时,钠离子和氯离子个数比也为1:1,则此时溶液中的溶质为氯化钠,且二氧化碳能溶于水,溶液中还有二氧化碳。
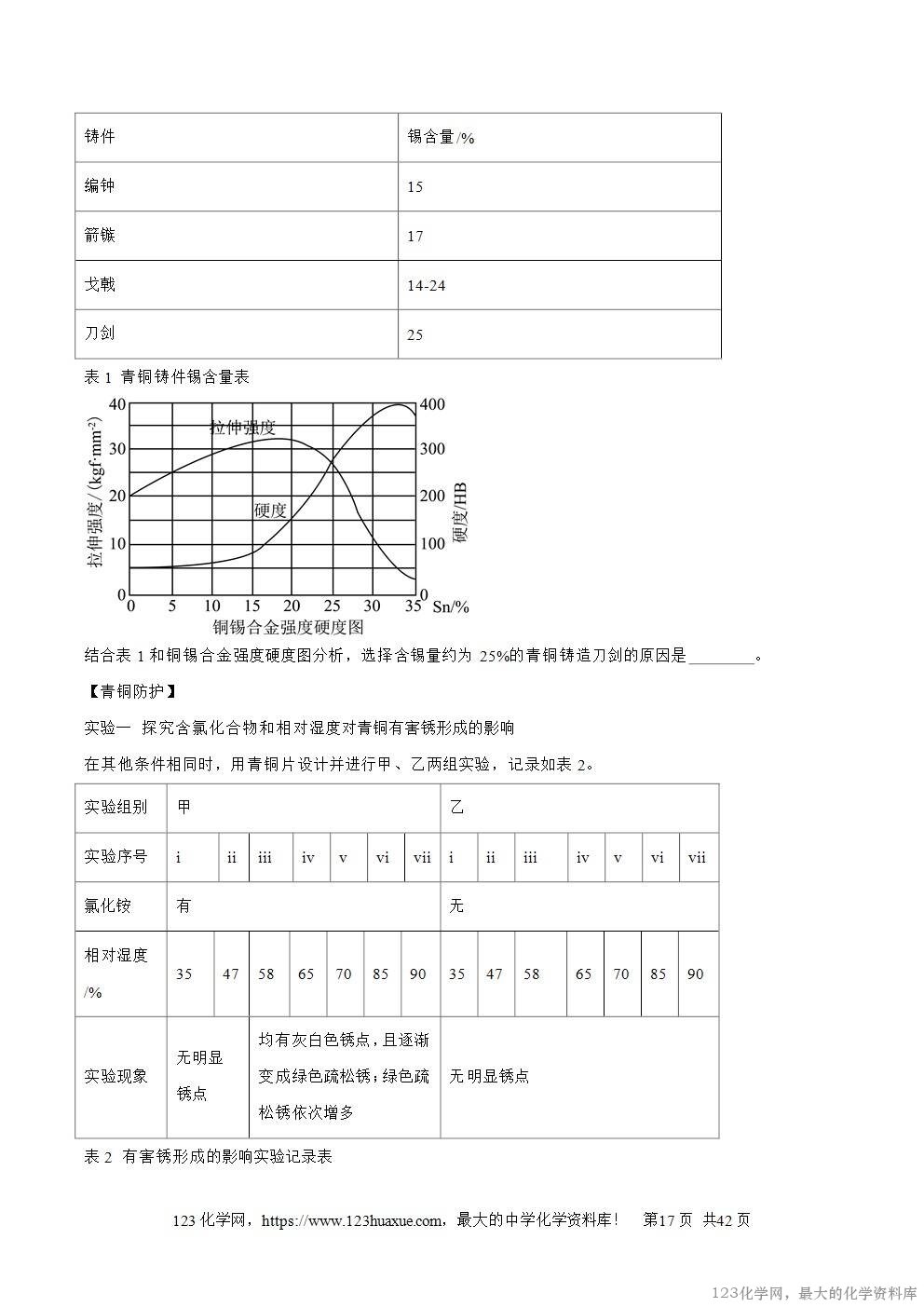
3.(2025·福建省)博物院油画馆的讲解员告知同学们,油画若保存不当,其中的红铅颜料在空气中