
提示:多个视频只播放第一个文件,完整视频请下载后播放。
“水溶液中的多重平衡体系”单元教学(第 2 课时)——以“缓冲溶液”为例
(芜湖市第十二中学 教师姓名:鲁静 指导教师:陈波 曹林翔)

















一、课标呈现
【内容要求】从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、
性质和反应;了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、
物质转化中的应用。了解溶液 pH 的调控在工农业生产和科学研究中的应用。
【教学策略】 结合自然现象(如海水的酸碱性及其变化)、生活问题的解
决(如明矾净水)、生产实际(如矿石中有效成分的提取),组织学生开展分析
解释、方案设计等活动,促进学生认识水溶液中的离子反应与平衡对生产、生活
和社会发展的作用。
【情境素材建议】水溶液中离子平衡的应用实例,如弱酸的制备、铝盐和铁
盐的净水作用、缓冲溶液及其作用、溶洞和珊瑚礁的形成,以及可溶性钡盐的工
业生产等。
【学业要求】能进行溶液 pH 的简单计算,能正确测定溶液 pH,能调控溶
液的酸碱性;能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有
关电解质溶液的实际问题。
二、教学内容分析
1. 内容分析
本节课课题选自于人教版化学选择性必修 1《化学反应原理》第三章《水溶
液中的离子反应与平衡》,理论上应作为课本内容的复习课时,是基于学生已有
认知模型所进阶的探究课时。课标中明确指出要通过对水溶液中离子反应与平衡
的分析,形成并发展学生的微粒观、变化观和平衡观;同时,基于宏观现象、实
验数据等实证素材,引导学生建构认识水溶液中离子反应与平衡的基本思路。
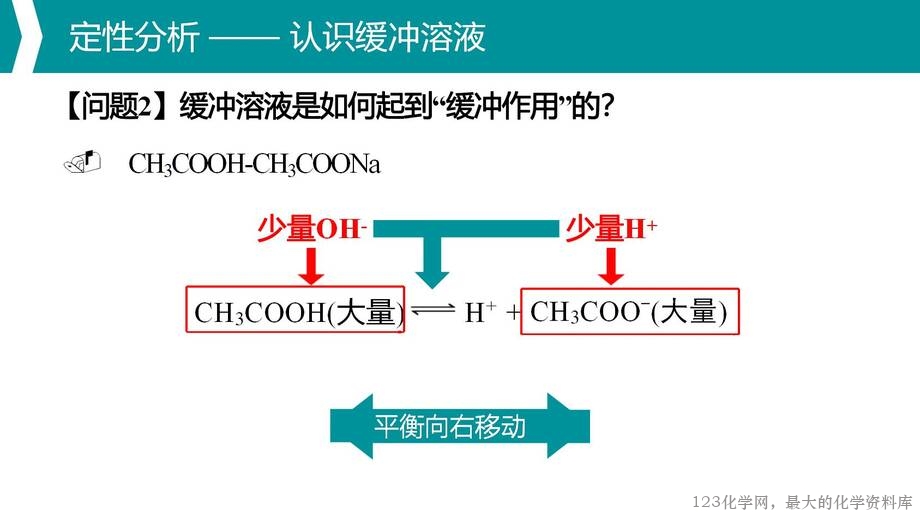
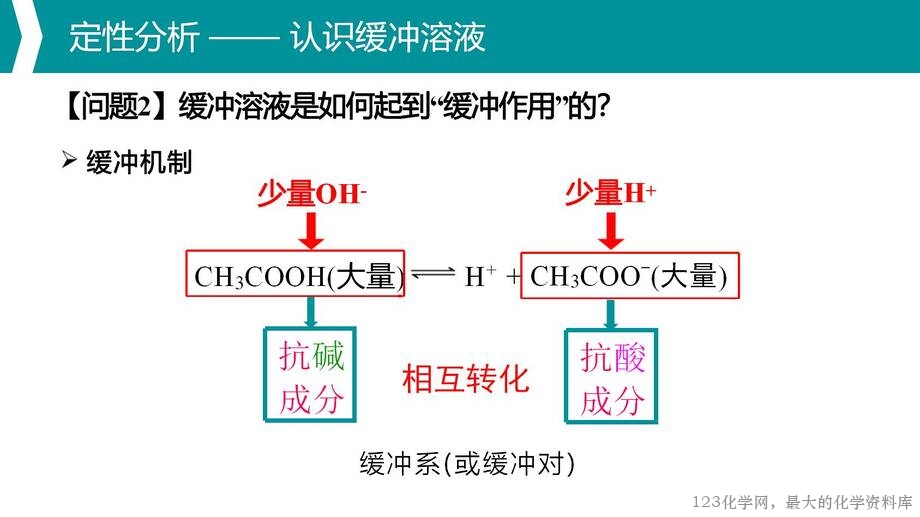
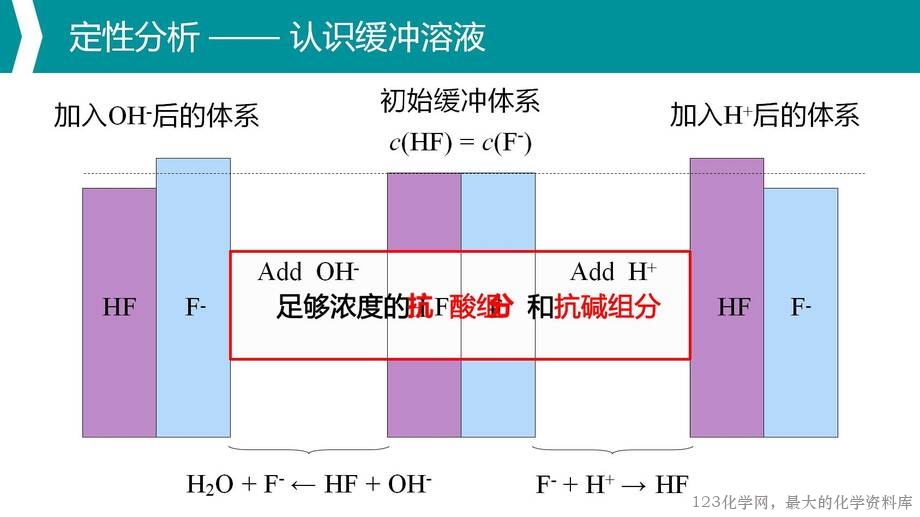
缓冲溶液,作为课标中明确提及的情境素材,是一个构成复杂、应用广泛的
水溶液体系。本节课以其为载体,围绕缓冲溶液的定义、缓冲机制、组成、形成
与限度、pH 计算与广泛应用,进行水溶液中多重平衡体系的分析与应用,以期
- 1 -
提高学生运用基本理论和方法解决水溶液中的反应和生产生活中实际问题的能力,促进学生的认知发展。
2. 素养呈现
“素养为本”的教学是以学生已有的认知为起点,通过学习核心知识和核心概念等教学活动的开展,实现知识的内化,促成学生核心素养的发展,课堂则是促进学生核心素养发展的主要场所。
本节课采用“提出问题—引入化学知识—解决问题”开展教学,从“缓冲溶液维持人体酸碱平衡”、“国家非遗蓝印花布的染色维稳”引入,通过学生实验、小组交流等定性认识缓冲溶液,促进学生理解,培养学生的“宏观辨识与微观探析”、“科学态度与社会责任”素养。随后,基于学生已有认知设置问题链,引导学生积极进行类比、分析完成“缓冲溶液”中“多重平衡体系”的定性学习,并建构认知模型,通过思维活动培养学生的“变化观念与平衡思想”、“证据推理与模型认知”素养。紧接着由定性分析过渡到定量研究,以数字化实验为载体,探究缓冲溶液的形成与限度,通过创设认知冲突,激发学生兴趣,并辅以 pH 计算的思维活动,循序渐进地分析并解决问题,完善对于多重平衡体系的认知模型,培养学生的“科学探究与创新意识”、“证据推理与模型认知”素养。最后结合缓冲溶液的案例“血液中的缓冲体系”提出问题,用所学知识解决实际问题,促进学生在潜移默化中完成知识的迁移应用,使学生认识到化学与生活息息相关,自觉运用化学思维解决日常生活中的具体问题,达到良好的教学效果,培养学生的证据推理与模型认知”、“科学态度与社会责任”素养。
三、学情分析
本节课为“水溶液中的离子反应与平衡”的复习专题课,授课对象为高三学生。在必修课程中,学生“认识了酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。通过实验事实认识了离子反应及其发生的条件”;在此基础上,学生通过选择性必修课程学习,从化学平衡的角度认识电离平衡、水解平衡、沉淀
溶解平衡以及离子反应与平衡的应用等知识。
但实际上学生对水溶液中的离子平衡认识水平较低,多是基于简单规律、结
论、定性水平的简单认识,没有深入到对离子平衡本质的认识,对离子平衡相关
定量数据的关注也较少。对于多种溶质存在的多重离子平衡体系以及相应的离子
- 2 -
反应的认识,也多是简单的规律、结论,缺乏预测和解释的能力,未认识到这一
类反应的本质。以上这些发现说明学生对水溶液中的离子反应与平衡的认识不够
深入和系统。
四、教学目标
1. 通过趣味实验定性认识缓冲溶液,掌握缓冲溶液的定义、作用原理及组成;
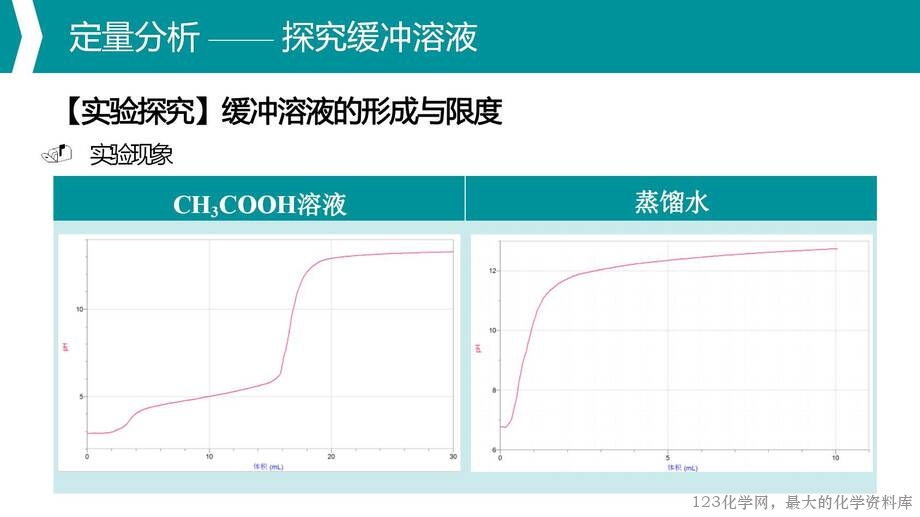
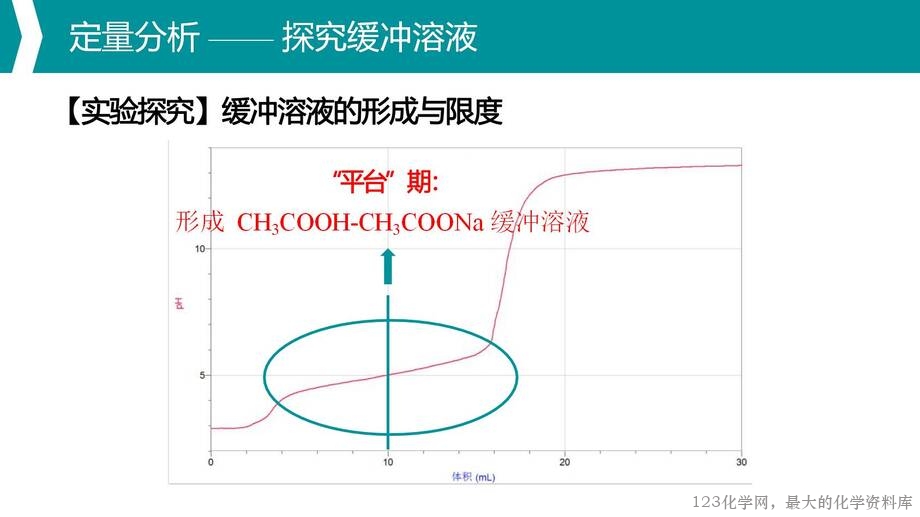
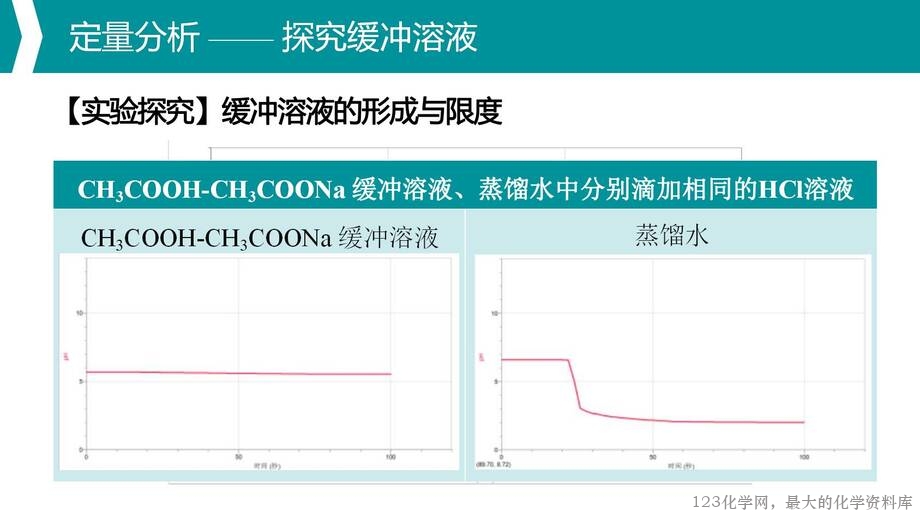
2. 通过数字化实验定量探究缓冲溶液,理解缓冲溶液的形成及其具有限度的特性;
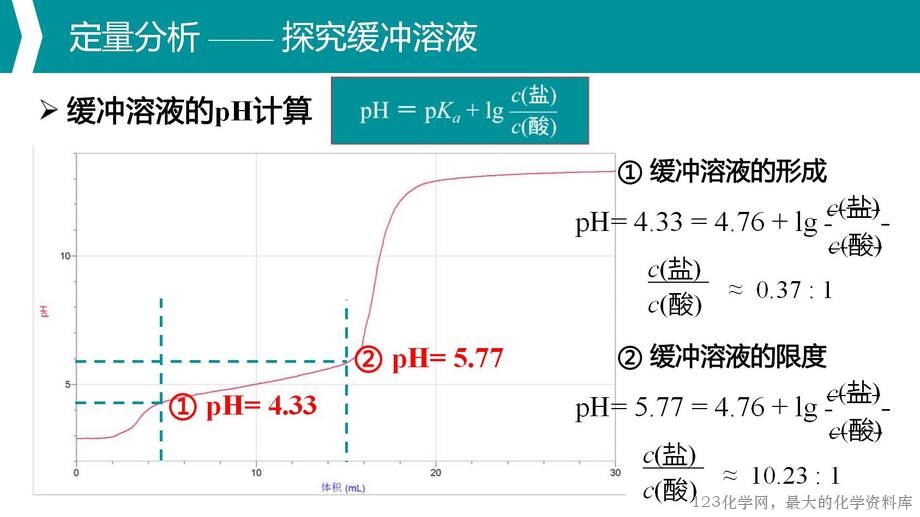
3. 通过缓冲溶液 pH 计算公式的推导,培养学生的逻辑思维推理能力和科学计算能力;
4. 通过理论分析与实验探究相结合,引导学生应用已有知识逐步分析问题,初步建构多重平衡体系分析思路的模型。
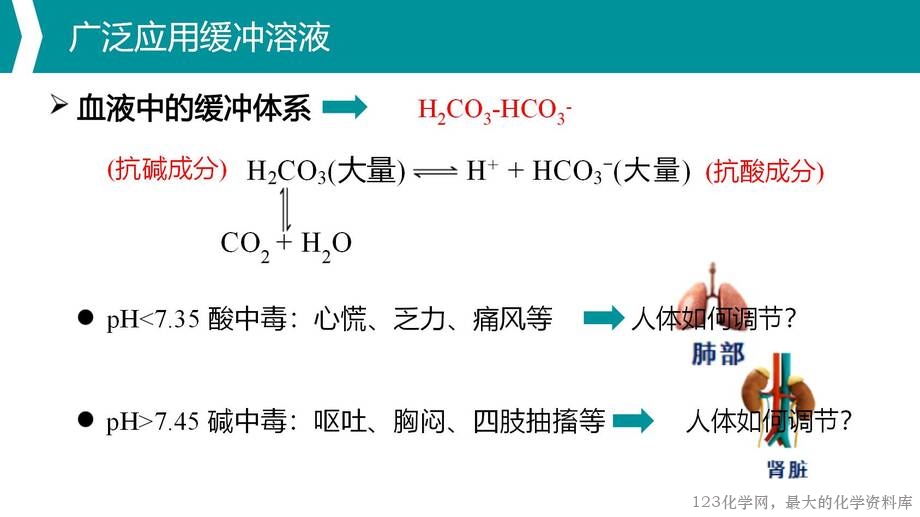
5. 运用缓冲溶液的相关知识解决生命科学及生活中的实际问题,使学生初步具有科学思维和进行科学研究的方法和技能,逐步培养学生严谨的科学态度、学以致用的意识,让学生感受到探索的乐趣和成功的喜悦,充分体会化学知识在实际生活中的广泛应用。
五、教学方法
实验探究法、任务驱动法、启发式教学法
六、实验用品
蒸馏水、 pH=4.4 CH3COOH 溶液、 pH=7.4 CH3COONa 溶液、 pH=5.4
CH3COOH-CH3COONa 缓冲溶液、0.1 mol/L HCl 溶液、0.1 mol/L NaOH 溶液、
甲基橙指示剂、酚酞指示剂;0.1 mol/L CH3COOH 溶液、0.5 mol/L NaOH 溶液;
试管、试管架、烧杯、铁架台、磁子、磁力搅拌器、pH 传感器和滴数传感器。
七、教学重难点
1. 重点:缓冲溶液的缓冲机制;缓冲溶液的形成与限度;利用缓冲溶液知识分析并解决生命科学问题等。
2. 难点:缓冲溶液的 pH 计算;缓冲溶液的形成与限度;初步建构多重平衡体系分析思路的模型。