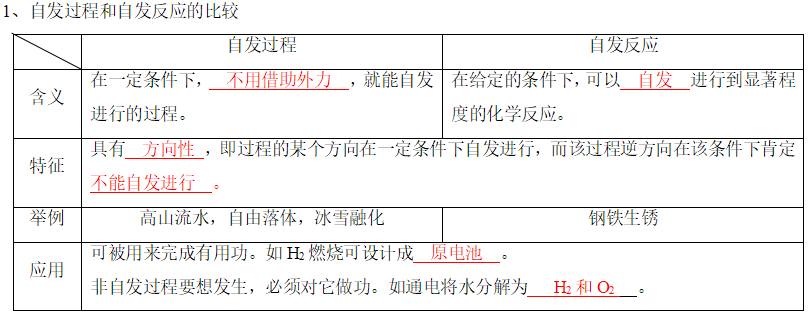
(1)焓变与反应的方向
放热反应过程中体系能量降低,因此具有自发进行的倾向,科学家提出用焓变来判断反应进行的方向,这就是焓判据。
①多数放热反应是自发进行的。例如燃烧反应、中和反应等。②有些吸热反应也可以自发进行,如:
2N2O5(g)⇄4NO2(g)+O2(g) ΔH=+109.8kJ·mol-1。
(2)熵变与反应的方向
①体系的熵值:体系的混乱程度越大,体系的熵值就越大。
②同一物质的熵值:S(g)>S(l)>S(s),同一条件下,不同物质的熵值不同。
(3)熵判据:体系有自发地向混乱度增加(即熵增)的方向转变的倾向,因此可用熵变来判断反应进行的方向。
自由能与化学反应的方向
(1)自由能:符号为ΔG,单位为kJ·mol-1。
(2)自由能变化与焓变、熵变的关系:ΔG=ΔH-TΔS。ΔG不仅与焓变有关,还与温度有关。
(3)反应方向与自由能的关系
①当ΔG<0时,反应能自发进行;
②当ΔG=0时,反应处于平衡状态;
③当ΔG>0时,反应不能自发进行。