
提示:多个视频只播放第一个文件,完整视频请下载后播放。
碧水计划之废水处理中的沉淀溶解平衡问题
第2课时 沉淀溶解平衡的调控
授课教师:安徽省蚌埠第一中学 龚道玉















【教学过程】
环节一:分析氢氧化镁处理酸性废水的原理
创设情境:在废水处理中, 水处理剂扮演了重要的角色。氢氧化镁由于其安全、无毒、无害、 使用效果好等优点被称为是“环境友好型” 的绿色安全废水处理剂, 可以综合酸性废水和沉降 重金属离子。
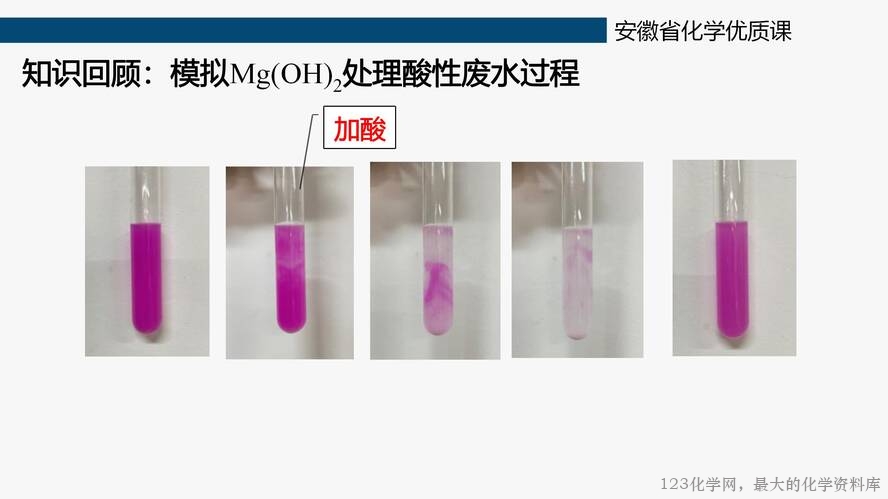
知识回顾:上一节课模拟了氢氧化镁处理酸性废水的过程,实验现象如图所示。
图 1 模拟氢氧化镁处理酸性废水的实验现象
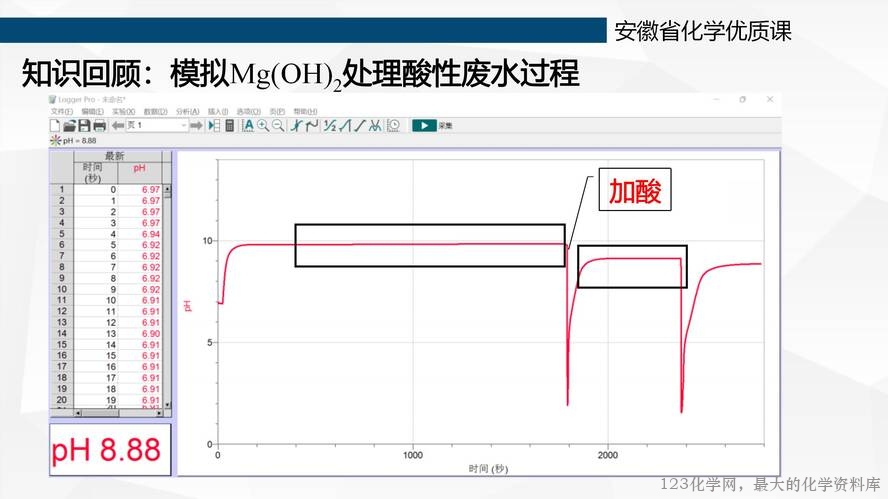
知识回顾:使用传感器测定了 pH 的变化
图 2 模拟氢氧化镁处理酸性废水的 pH 变化图
问题串 1:①结合实验现象和 pH 曲线,分析 pH 是如何变化的?②原理是什么?
活动 1:学生基于现象和图像分析, pH 先不变、加酸后 pH 先减小后增大、 一段时间后保持 不变。
活动 1-续:氢氧化镁先建立沉淀溶解平衡, 加酸后平衡被破坏, 一段时间后又重新达到平衡, 说明沉淀溶解平衡是“动态平衡 ”。
评价 1:评价学生现象与原理的关联水平。
(设计意图引导学生基于实验现象、数据等证据素材, 认识水溶液中的离子平衡, 建立与化 学原理之间的关联,挖掘现象背后所蕴含的本质和规律,发展微粒观)
问题 2:如何判断平衡的移动方向?
活动 2:学生讨论, 得出结论。依据浓度商 Q 和平衡常数 Ksp 的关系, 当 Q>Ksp 平衡逆向 移动,体现为沉淀生成;Q=Ksp 达到平衡状态,Q<Ksp 平衡正向移动,体现为沉淀溶解。评价 2:通过学生的回答,评价已有知识的掌握和迁移水平。
(设计意图基于已有的 Q 和平衡常数的关系,判断平衡移动的方向、分析沉淀的溶解和生 成原理, 从已有的对化学平衡的认识角度出发, 通过知识迁移、类比分析, 认识沉淀溶解平 衡的本质特征和要素,发展学生的平衡观念)
问题串 3:①结合 Q 和 Ksp 的关系,分析 Mg(OH)2 处理酸性废水的原理;②为什么处理过 的废水仍然呈弱碱性?③该过程的总反应是什么?
活动 3:小组讨论,得出规律。学生总结:废水中的 H+与 OH-反应生成水,使 OH- 的浓度 降低,使 Q <Ksp[Mg(OH)2] ,Mg(OH)2 沉淀溶解平衡向沉淀溶解的方向移动。
图 3 氢氧化镁处理酸性废水的微观原理图
活动 3-续:处理过的废水呈弱碱性,因为过量的 Mg(OH)2 在新的条件下继续建立沉淀溶解 平衡。经过分析和讨论,明确总反应为 Mg(OH)2(s)+2H+(aq) ⇌Mg2+(aq) +2H2O(l)
评价 3:评价学生能否从定量的视角,使用沉淀溶解平衡模型分析沉淀的溶解,诊断学生能 否正确使用化学用语说明反应的原理。
(设计意图在定性分析的基础上,通过应用 Q 和 Ksp 的关系分析实际问题,分析沉淀溶解 的微观过程和原理, 从而帮助学生形成定性、定量结合的双重视角认识平衡的溶解, 形成判 断平衡移动方向的方法和策略。此外, 考察学生能否运用化学用语进行正确的表达, 提升学 生符号表征的意识)
环节 2:研究镁离子对废水碱性的影响
问题 4:工厂产生的废水中除了 H+之外,往往还有 Mg2+ 、Cu2+等金属离子。过量的 Mg2+会 对除酸后废水的碱性产生影响吗?如何设计实验方案呢?
试剂:废水(含酚酞)、1mol/L MgSO4 溶液、蒸馏水;仪器:试管、 一次性塑料滴管。
活动 4:学生讨论,师生共同设计方案。
表 1 探究镁离子对废水碱性影响的定性实验 学生实验 1
实验目的:探究镁离子对废水碱性的影响
实验组
对照组
从废水中取 4mL 上层清液于试管,加
入 2mL 1mol/L MgSO4 溶液, 振荡、观
察颜色变化
从废水中取 4mL 上层清液于试管,加入
2mL 蒸馏水,振荡、观察颜色变化
活动 4-续:完成并记录实验现象,汇报结果。实验组废水的红色比对照组浅,说明镁离子 的过量存在会使废水的碱性减弱。 探究镁离子对废水碱性的影响实验现象
评价 4:通过对实验方案的讨论、实验操作的点评,诊断学生方案设计和实验探究水平。
(设计意图在对实验方案的讨论中, 发现部分学生能设计出实验组, 但无法准确地识别出实 验组中硫酸镁溶液中的水也有可能对实验结果造成干扰, 教师通过交流和追问的方式, 使学 生能够意识到控制变量在实验设计中的重要性, 例如实验组和对照组药品的加入顺序、体积 要控制相等,发展学生设计方案、评价方案、优化方案的能力)
问题 5:废水的颜色变浅,说明碱性减弱、pH 减小, pH 减小到多少呢?借助更加精密的仪 器——pH 传感器进行测定。