





(1) 通过探究认识碱金属元素性质的递变规律,并能用原子结构理论初步加以解释同主族元素性质的递变规律;
(2) 通过碱金属元素的相关性质的图表信息,培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
【内容分析】
本节课以碱金属元素为代表,呈现同族元素性质的相似性,引导学生从中发现规律。
在前面的学习中,学生已经学习了原子结构和元素周期表,本节依托于元素周期表中的典型的金属元素----碱金属元素,诠释了原子结构与元素性质的关系。教材重点阐述了元素的金属性与元素在周期表中的位置和原子结构的关系,目的是帮助学生提高应用周期表分析问题和解决问题的能力,进一步建构“构”“位”“性”的关系,形成结构决定性质的观念。教材以“演绎---归纳”的方式,从原子结构和元素周期表出发,演绎元素的性质,再以理论和事实为依据,归纳得出同主族元素性质的变化规律。
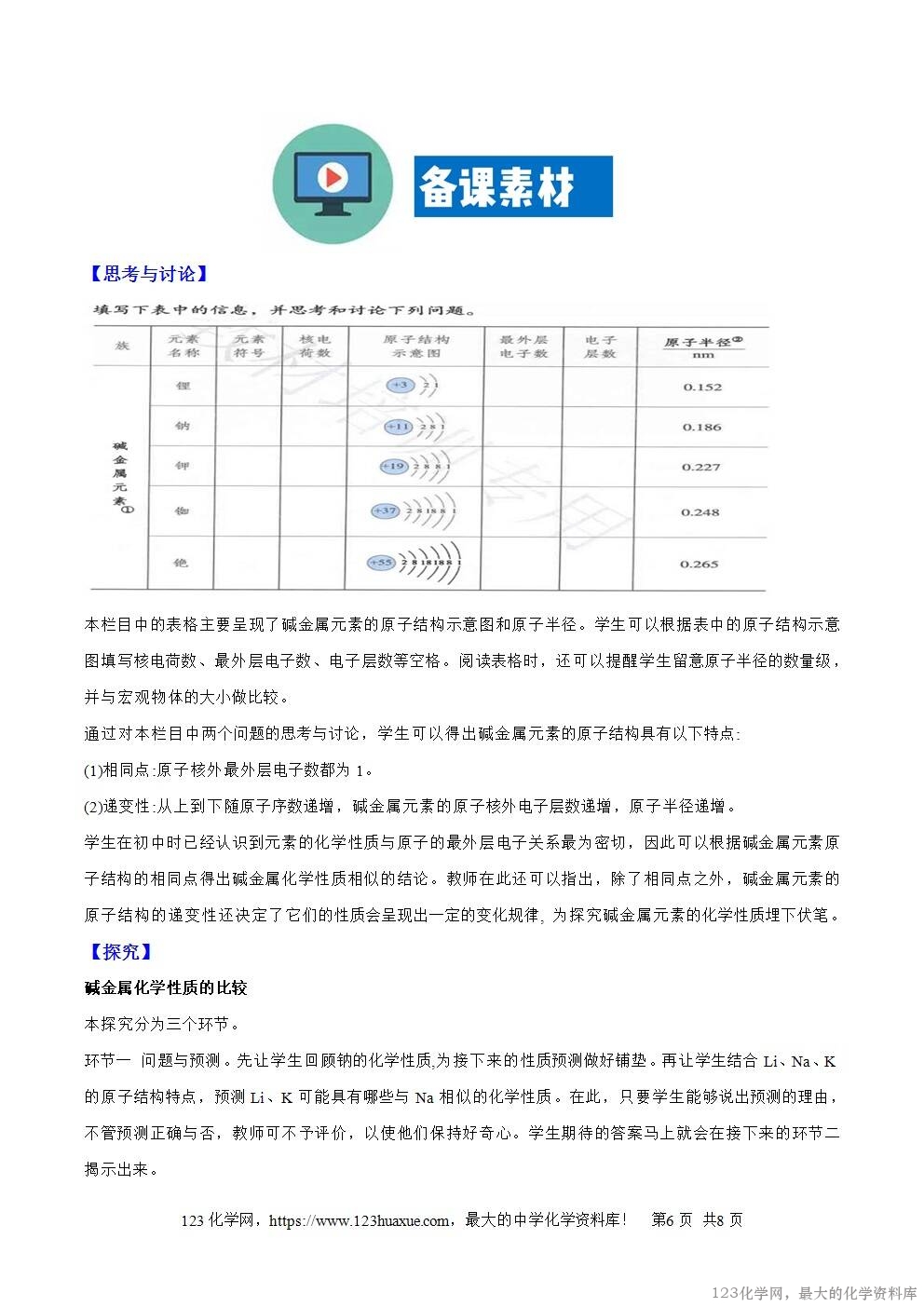
此外,周期表的重要作用之一, 是使学生能够通过周期表的位置和元素的原子结构,预测元素的性质,发现新元素。教材在本节的呈现突出体现了这一作用。教材呈现的周期表中碱金属元素的性质,就是从“预测”出发的。例如,碱金属的性质是通过探究活动“碱金属性质的比较”,采用“预测----验证(实验)----分析----结论”的思路归纳出来的。;学生可以通过这样的过程体会元素周期表的作用。同时,教材在“方法导引”中介绍了“预测”这一科学方法。这些编排有利于学生认识到科学方法对研究和学习的意义。
【教学重点和难点】
重点:碱金属元素性质的相似性和递变性
难点:原子结构与碱金属元素性质的关系
【教学流程】
【学习任务一】认识碱金属的化学性质
人们常说,结构决定性质。元素周期表中,同族元素之间有什么联系呢?
【问题和预测】
方法导引:预测是在已有信息的基础上,依据一定规律和方法对未知事物所进行的一种推测。在化学研究中,可以根据物质的组成、结构和反应规律等,预测元素及其化合物的性质、可能发生的化学反应,并评估所作预测的合理性。
( 1)回忆第二章学过的知识,钠有哪些化学性质?
【答案】与O2、水、酸、盐溶液反应。
(2)结合锂、钠和钾的原子结构特点,请你预测锂、钾可能具有哪些与钠相似的化学性质。
【答案】与钠相似。与O2、水、酸、盐溶液反应。
【设计意图】通过理论探讨使学生体验通过周期表的位置和元素的原子结构,预测元素的性质。从而感受元素周期表的作用。
【科学探究】
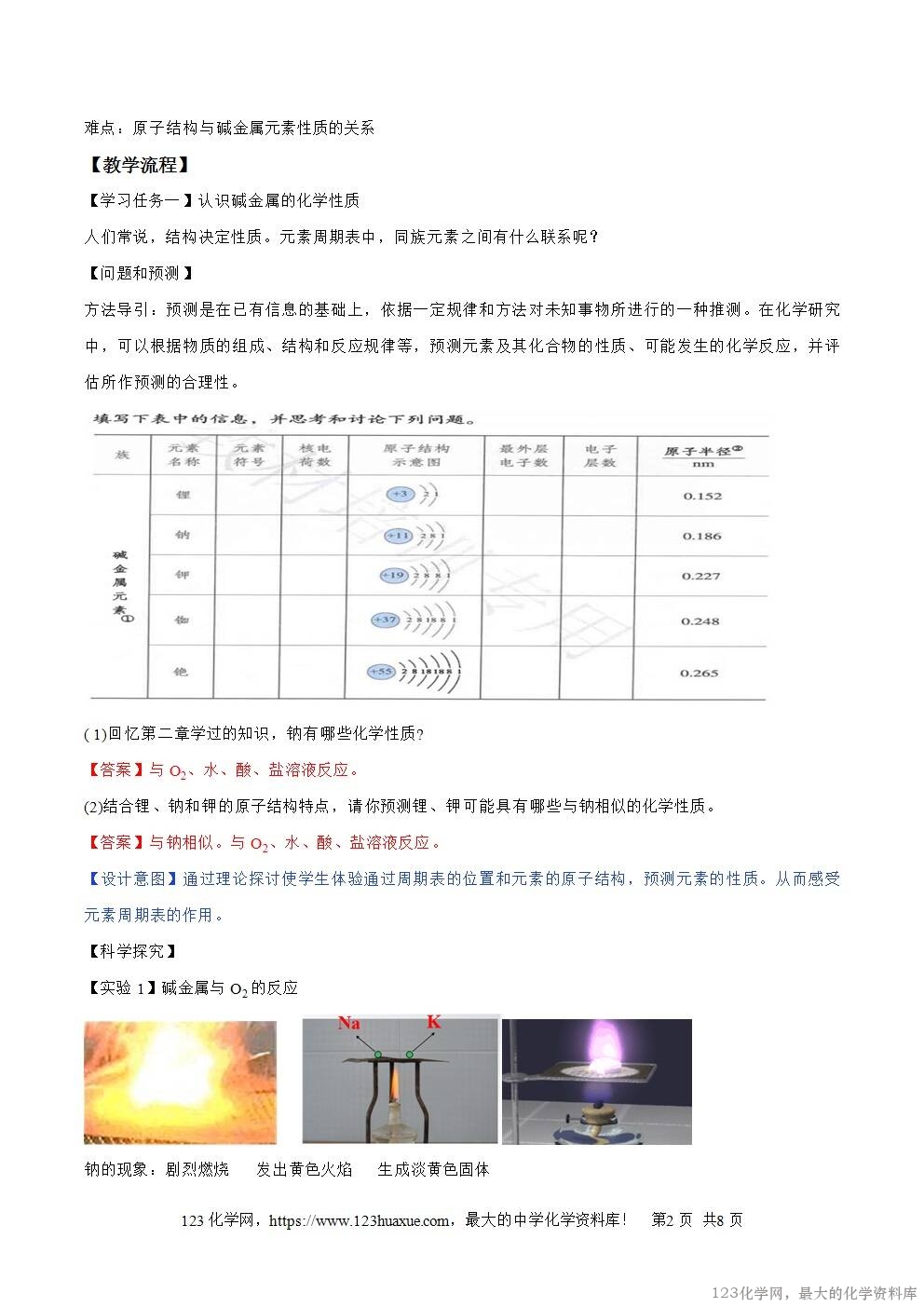
【实验1】碱金属与O2的反应
钠的现象:剧烈燃烧 发出黄色火焰 生成淡黄色固体
钾的现象:剧烈燃烧 发出紫色火焰 生成黄色固体
【结论】K比Na反应更快更剧烈
【小结】碱金属与O2的反应
【实验2】碱金属与水的反应
钠的现象和结论:浮、熔、游、响、红 2Na+2H2O=2NaOH+H2 ↑
钾的现象和结论:浮、熔、游、响、烧、爆、红 2K+2H2O=2KOH+H2↑
【设计意图】通过探究实验,亲身感悟碱金属元素性质的相似性和递变性,从而领悟元素周期表的魅力。
【小结】碱金属化学性质的相似性和递变性与原子结构的关系
【注释】金属性:元素原子失去电子的性质
一般情况下,元素的金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物一氢氧化物的碱性强弱来判断。
【设计意图】通过归纳总结,构建原子结构与物质性质的关系,突破教学难点。
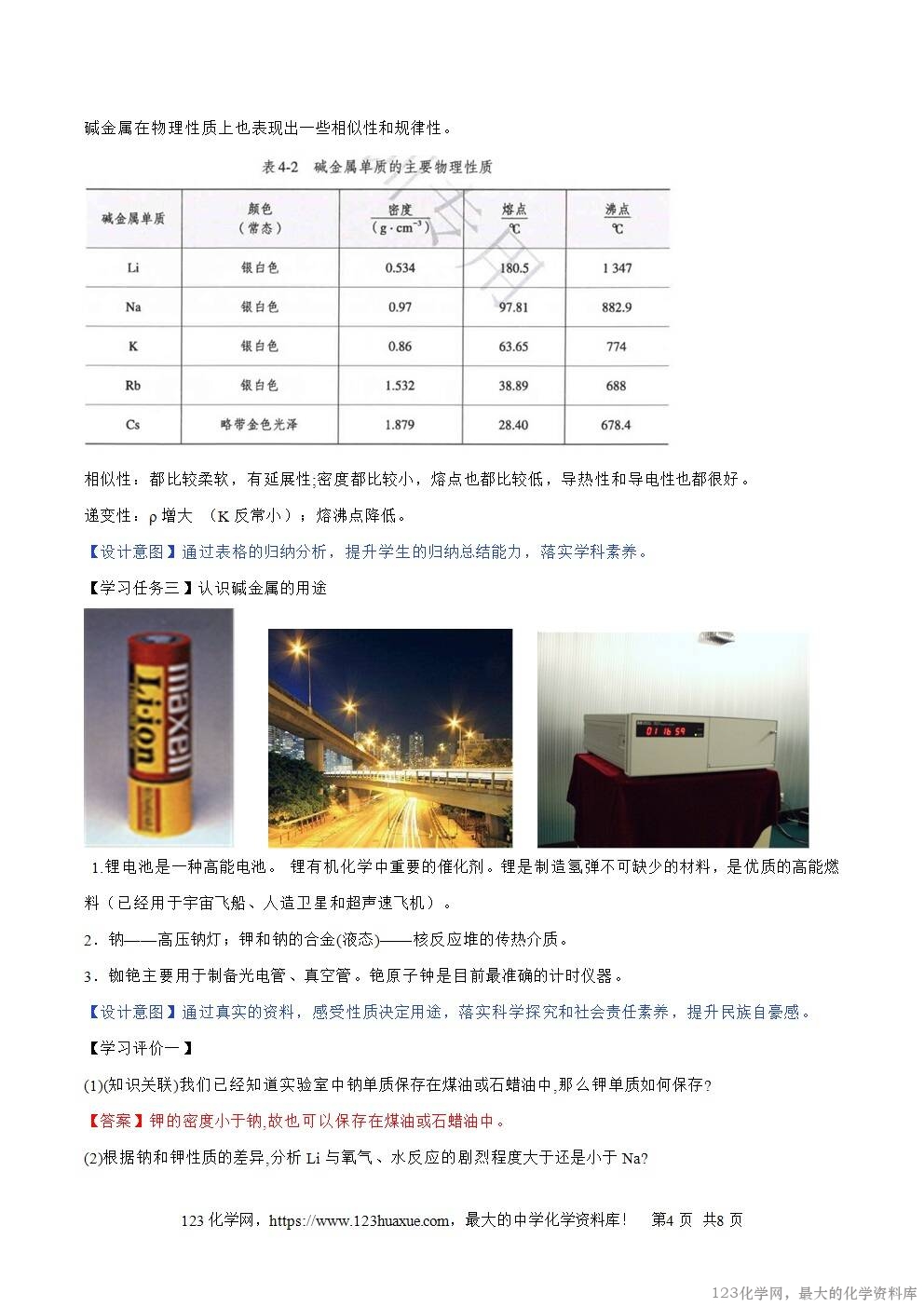
【学习任务二】认识碱金属的物理性质
碱金属在物理性质上也表现出一些相似性和规律性。