







(1) 通过探究认识卤族元素性质的递变规律,并能用原子结构理论初步加以解释同主族元素性质的递变规律;
(2) 通过卤族元素的相关性质的图表信息,培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
【内容分析】
本节课以卤族元素为代表,呈现同族元素性质的相似性,引导学生从中发现规律。
在前面的学习中,学生已经学习了原子结构和元素周期表,本节依托于元素周期表中的典型的非金属元素----卤族元素,诠释了原子结构与元素性质的关系。教材重点阐述了元素的非金属性与元素在周期表中的位置和原子结构的关系,目的是帮助学生提高应用周期表分析问题和解决问题的能力,进一步建构“构”“位”“性”的关系,形成结构决定性质的观念。教材以“演绎---归纳”的方式,从原子结构和元素周期表出发,演绎元素的性质,再以理论和事实为依据,归纳得出同主族元素性质的变化规律。
此外,周期表的重要作用之一, 是使学生能够通过周期表的位置和元素的原子结构,预测元素的性质,发现新元素。教材在本节的呈现突出体现了这一作用。教材呈现的周期表中卤族元素的性质,就是从“预测”出发的。例如,卤素的性质,是通过“思考与讨论”栏目,采用“预测--验证(事实)--分析--结论”的思路归纳出来的。学生可以通过这样的过程体会元素周期表的作用。同时,教材在“方法导引”中介绍了“预测”这一科学方法。这些编排有利于学生认识到科学方法对研究和学习的意义。
【教学重点和难点】
重点:卤族元素性质的相似性和递变性
难点:原子结构与卤族元素性质的关系
【教学流程】
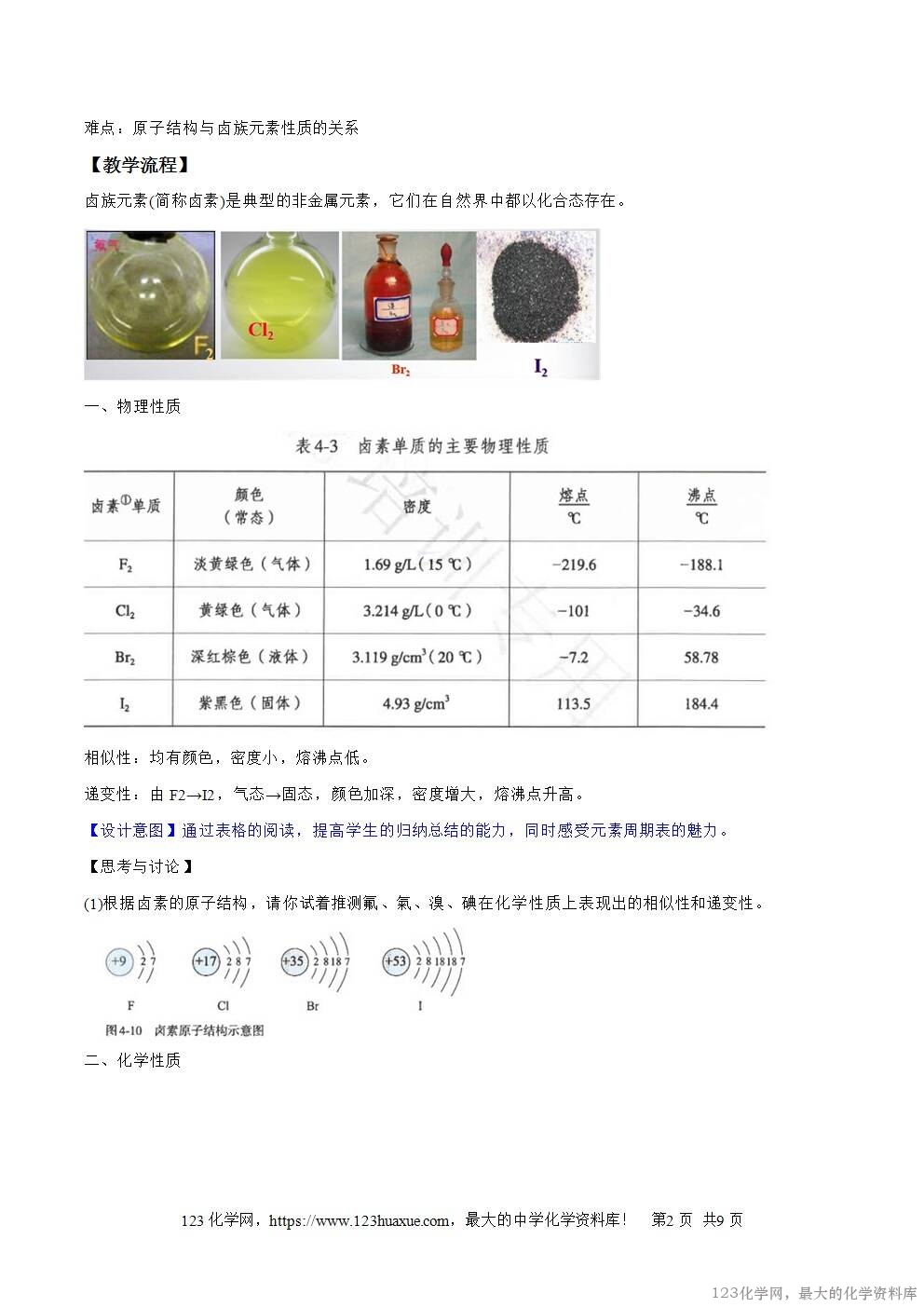
卤族元素(简称卤素)是典型的非金属元素,它们在自然界中都以化合态存在。
一、物理性质
相似性:均有颜色,密度小,熔沸点低。
递变性:由F2→I2,气态→固态,颜色加深,密度增大,熔沸点升高。
【设计意图】通过表格的阅读,提高学生的归纳总结的能力,同时感受元素周期表的魅力。
【思考与讨论】
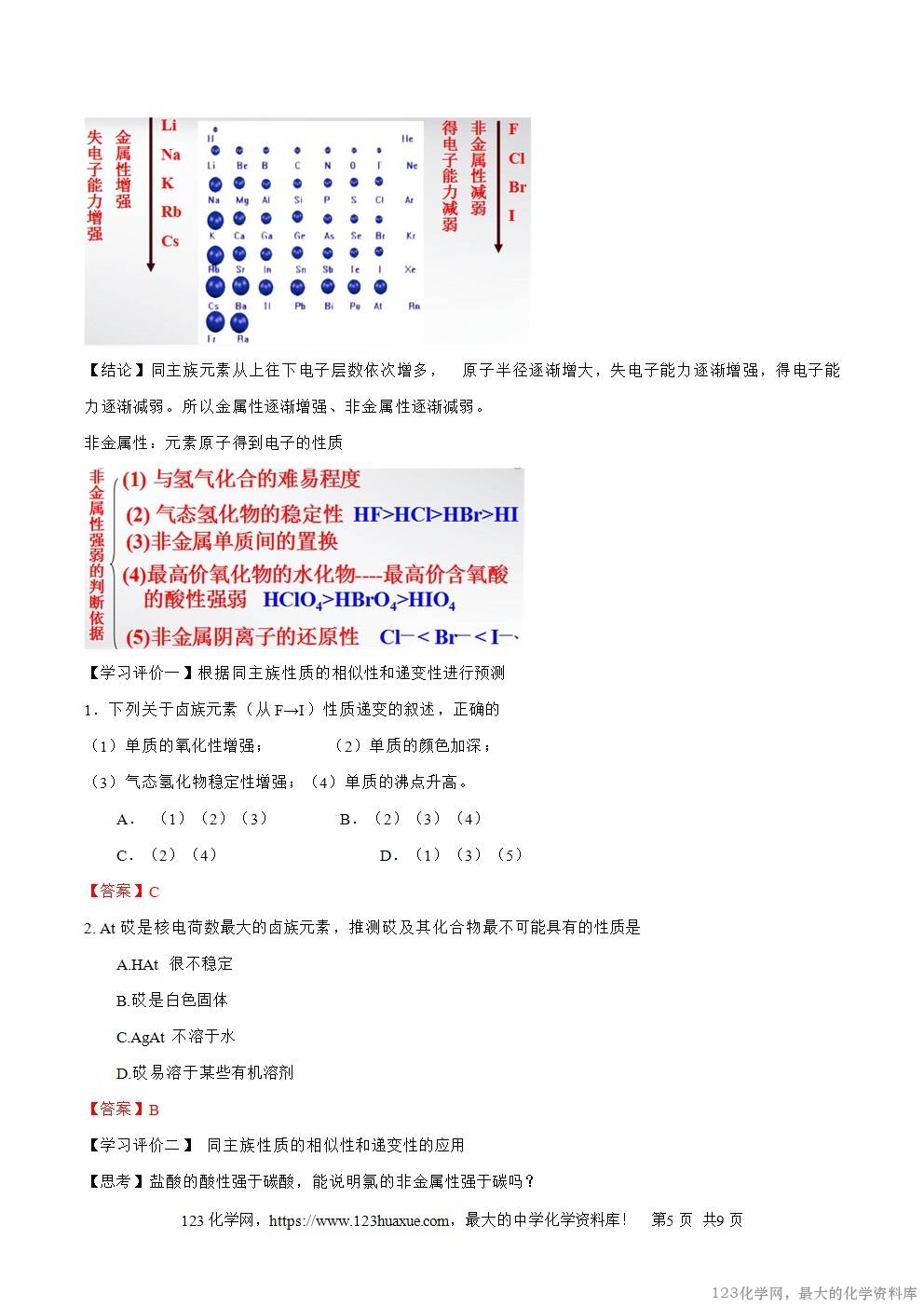
(1)根据卤素的原子结构,请你试着推测氟、氣、溴、碘在化学性质上表现出的相似性和递变性。
二、化学性质