




探究一分散系及分类
问题导引
1.分散剂必须是液体吗?
提示不一定。分散剂和分散质都可以是固体、液体或气体。
2.胶体区别于其他分散系的本质是什么?
提示胶体区别于其他分散系的本质是胶粒的直径在1~100nm之间。
探究二胶体的性质
问题导引
1.已知鸡蛋清是一种胶体,如何通过简便方法鉴别NaCl溶液和鸡蛋清胶体呢?
提示可通过产生丁达尔效应进行鉴别。当用光束通过NaCl溶液和鸡蛋清胶体时,从侧面能够观察到一条光亮“通路”的是鸡蛋清胶体。
2.向Fe(OH)3胶体中加入稀盐酸,先产生红褐色沉淀,继续滴加盐酸,红褐色沉淀又溶解,为什么?
提示向Fe(OH)3胶体中加入稀盐酸,胶体先发生聚沉形成Fe(OH)3沉淀,继续滴加盐酸,酸碱发生中和反应,Fe(OH)3沉淀又溶解。
【重点突破】
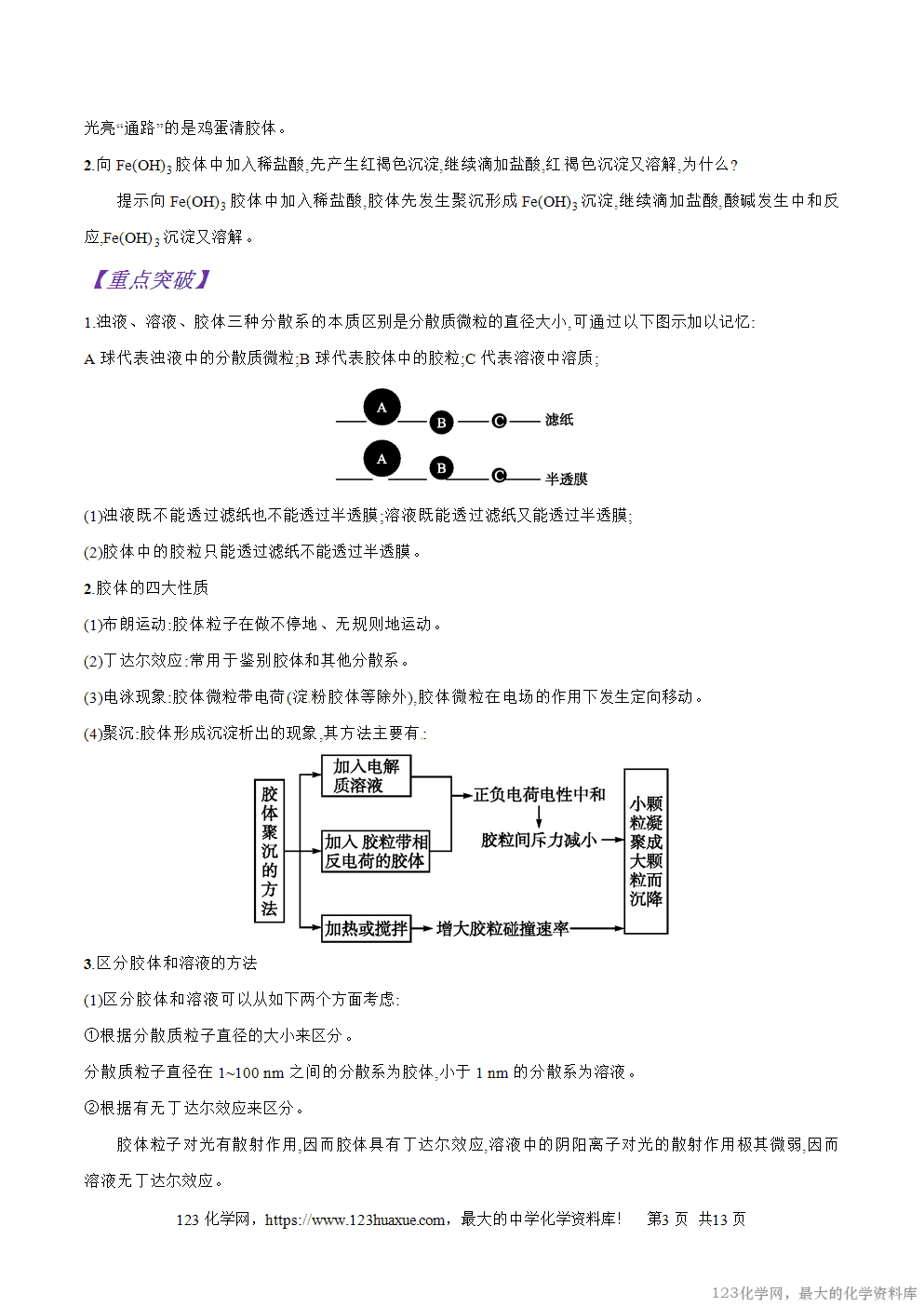
1.浊液、溶液、胶体三种分散系的本质区别是分散质微粒的直径大小,可通过以下图示加以记忆:[来源:学科网]
A球代表浊液中的分散质微粒;B球代表胶体中的胶粒;C代表溶液中溶质;
(1)浊液既不能透过滤纸也不能透过半透膜;溶液既能透过滤纸又能透过半透膜;
(2)胶体中的胶粒只能透过滤纸不能透过半透膜。
2.胶体的四大性质
(1)布朗运动:胶体粒子在做不停地、无规则地运动。
(2)丁达尔效应:常用于鉴别胶体和其他分散系。
(3)电泳现象:胶体微粒带电荷(淀粉胶体等除外),胶体微粒在电场的作用下发生定向移动。
(4)聚沉:胶体形成沉淀析出的现象,其方法主要有:
3.区分胶体和溶液的方法
(1)区分胶体和溶液可以从如下两个方面考虑:
①根据分散质粒子直径的大小来区分。
分散质粒子直径在1~100 nm之间的分散系为胶体,小于1 nm的分散系为溶液。
②根据有无丁达尔效应来区分。
胶体粒子对光有散射作用,因而胶体具有丁达尔效应,溶液中的阴阳离子对光的散射作用极其微弱,因而溶液无丁达尔效应。
(2)下列两个方面不能用来区分胶体和溶液:
①是否均一、透明。因为胶体和溶液通常都是均一、透明的分散系。
②是否能通过滤纸。因为胶体和溶液的分散质粒子均能通过滤纸。