


探究一对气体摩尔体积的理解
问题导引
标准状况时的气体摩尔体积示意图
1.气体摩尔体积的适用对象是气体,是否必须为纯净气体?
提示 不一定。可以是纯净气体,也可以是混合气体。
2.标准状况下的气体摩尔体积Vm=22.4 L·mol-1,那么Vm=22.4 L·mol-1时一定是标准状况下吗?
提示 不一定。同时改变温度和压强,气体摩尔体积Vm仍可能保持不变。如:升高温度的同时增大压强或降低温度的同时减小压强。
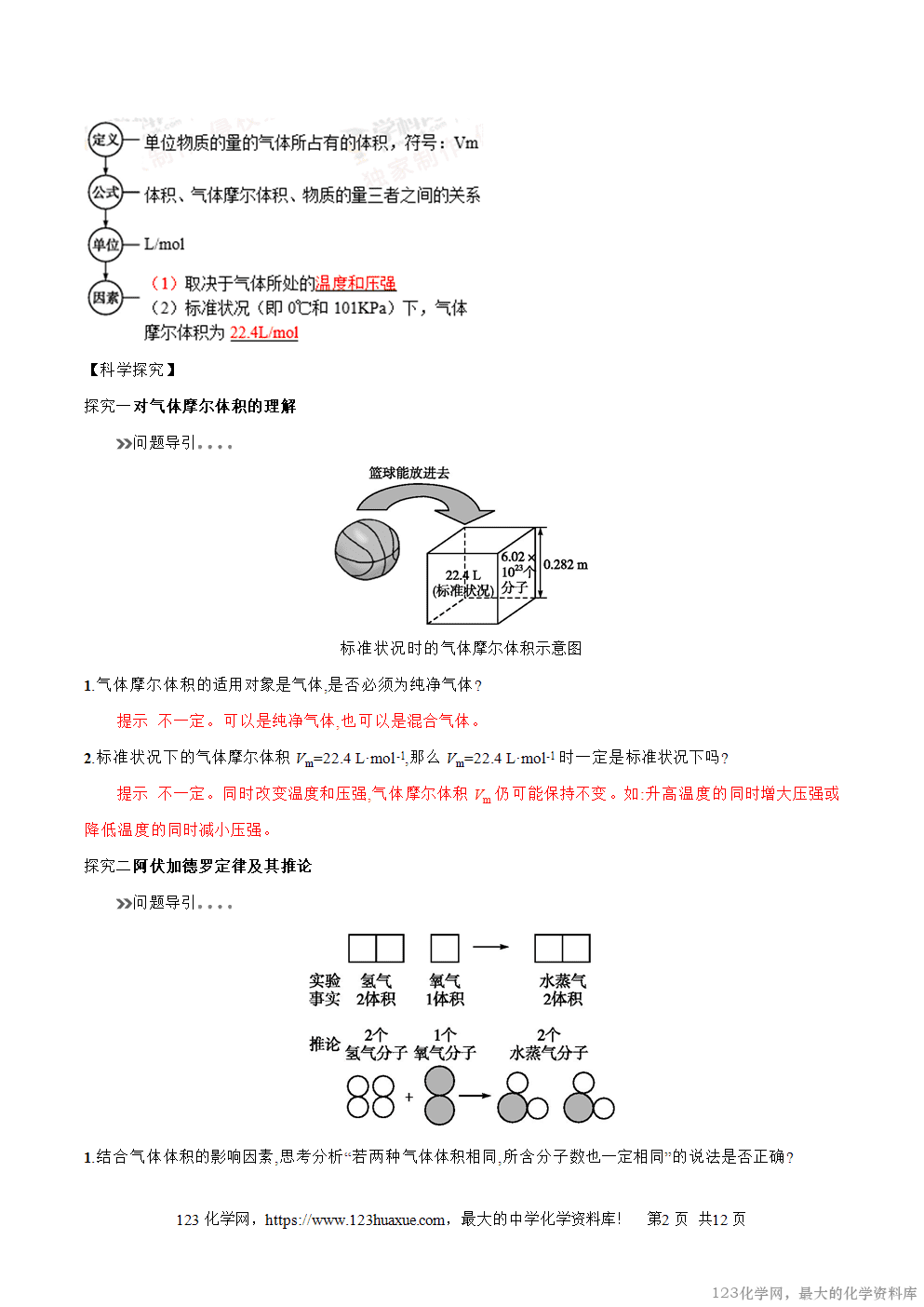
探究二阿伏加德罗定律及其推论[来源:学+科+网Z+X+X+K]
问题导引
1.结合气体体积的影响因素,思考分析“若两种气体体积相同,所含分子数也一定相同”的说法是否正确?
提示 不一定,因为气体体积受温度和压强的影响较大,若温度和压强不同时,体积相同的两种气体的物质的量不一定相同,故所含的分子数也不一定相同。
2.结合阿伏加德罗定律讨论同温同压同体积的O2和O3的分子数相同吗?能说原子数目也相同吗?
提示 由阿伏加德罗定律可知,同温同压下,体积相同的O2和O3分子数相同,又因为一个O2分子中有2个氧原子,一个O3分子中有3个氧原子,所以同温同压下,体积相同的O2和O3原子数目不同。
【重点突破】
1.气体摩尔体积的适用范围
气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。
2.标准状况下的气体摩尔体积
(1)定义:
(2)计算:
①气体的物质的量:n=。
②气体的摩尔质量:M=。
③气体的分子数:N=n·NA=·NA。
④气体的质量:m=n·M=·M。