


化学性质
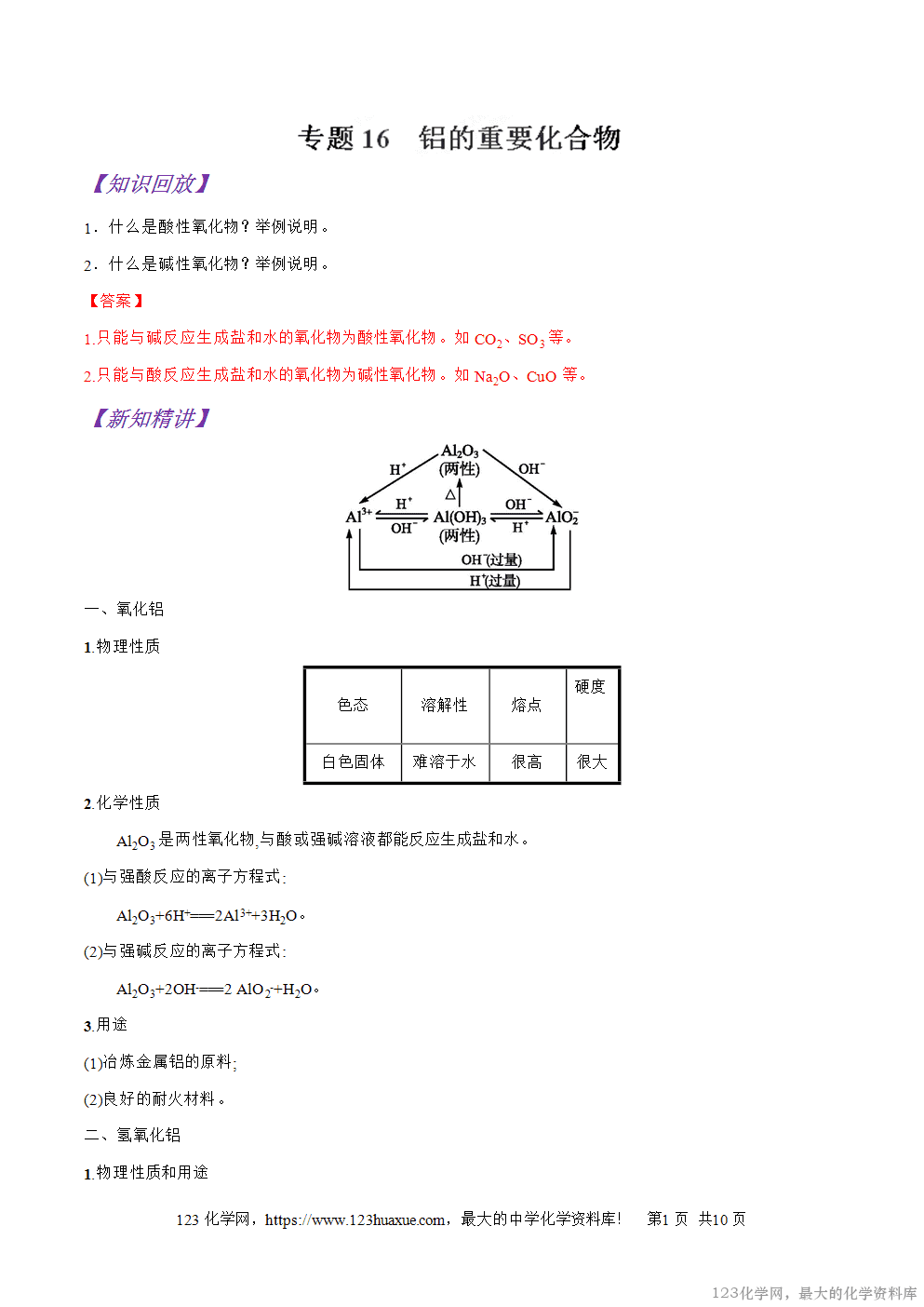
Al2O3是两性氧化物,与酸或强碱溶液都能反应生成盐和水。
(1)与强酸反应的离子方程式:
Al2O3+6H+===2Al3++3H2O。
(2)与强碱反应的离子方程式:
Al2O3+2OH-===2 AlO2-+H2O。
3.用途
(1)冶炼金属铝的原料;
(2)良好的耐火材料。
二、氢氧化铝
1.物理性质和用途
难溶于水的白色固体,在溶液中形成白色胶状沉淀。Al(OH)3能凝聚水中的悬浮物,又能吸附色素,可以用作净水剂。[来源:学。科。网]
2.化学性质
3.制备
(1)试剂:铝盐溶液和氨水。
(2)原理(离子方程式):Al3++3NH3·H2O===Al(OH)3↓+3 NH4+。
三、硫酸铝钾[KAl(SO4)2]
1.电离方程式:KAl(SO4)2===K++Al3++2SO42-。
2.十二水合硫酸铝钾[KAl(SO4)2·12H2O]。俗名明矾,为无色晶体,可溶于水,在天然水中生成Al(OH)3胶体,可用作净水剂。
【科学探究】[来源:Z+xx+k.Com]
探究一Al3+、AlO2-与Al(OH)3之间的转化
问题导引
Al3+、AlO2-与Al(OH)3之间的转化关系
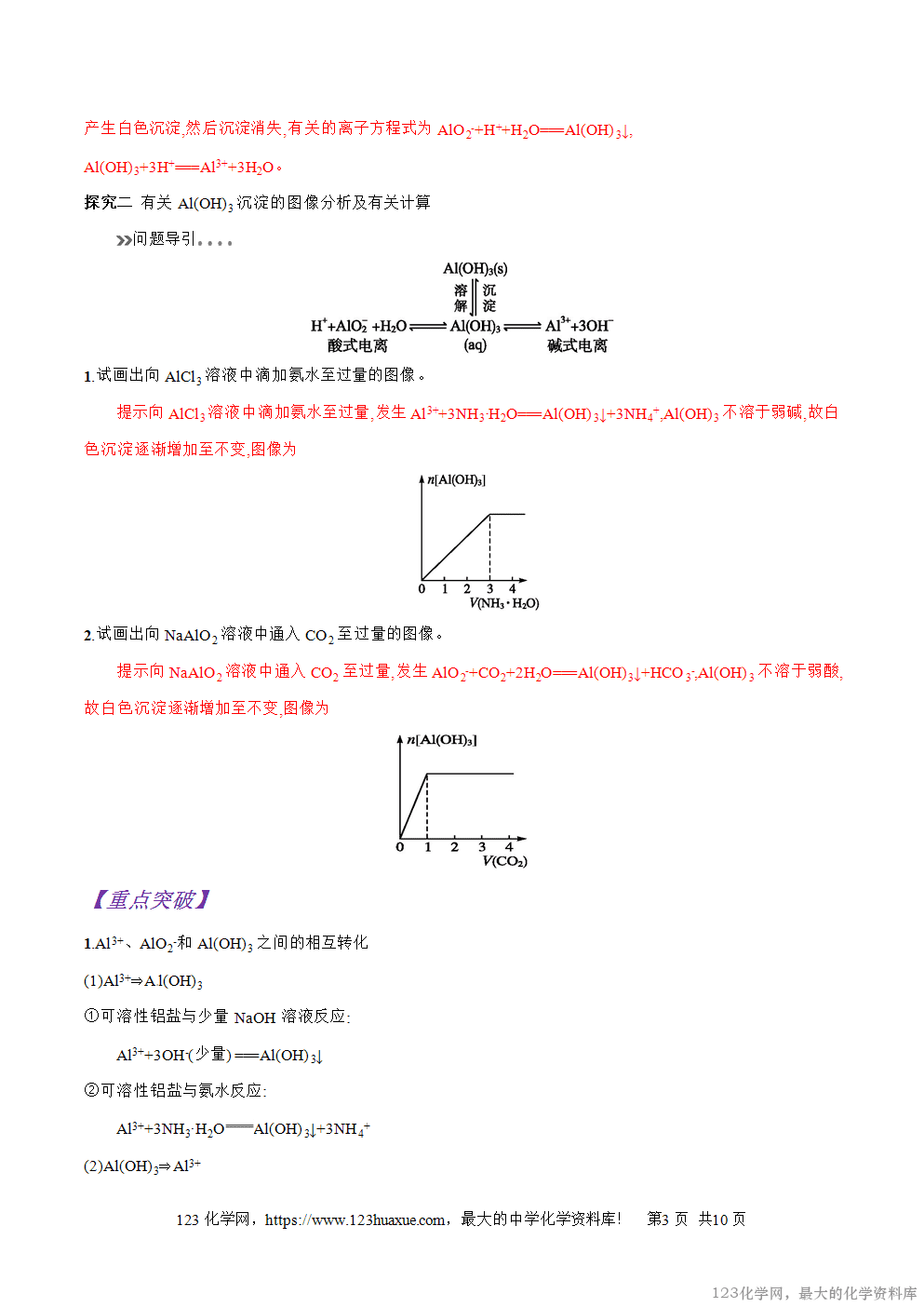
1.若在可溶性铝盐溶液中逐滴滴入NaOH溶液至过量,可以观察到什么实验现象?若将上述反应分为两个过程,试写出反应的离子方程式。
提示Al3+首先和OH-反应生成Al(OH)3沉淀,随着NaOH溶液的加入,Al(OH)3又和过量的NaOH溶液反
应,生成NaAlO2。故可观察到先产生白色沉淀,然后
沉淀逐渐消失。反应的离子方程式为Al3++3OH-===Al(OH)3↓,
Al(OH)3+OH-=== AlO2-+2H2O。
2.若向NaAlO2溶液中逐滴滴入稀盐酸至过量,能观察到什么现象?请写出对应的离子方程式。
提示 当向NaAlO2溶液中滴加稀盐酸时, AlO2-先与H+反应生成Al(OH)3沉淀,当溶液中的AlO2-完全转化为Al(OH)3后,再滴加稀盐酸时,生成的Al(OH)3又与过量的盐酸反应生成AlCl3,故观察到的现象为:溶液中先产生白色沉淀,然后沉淀消失,有关的离子方程式为AlO2-+H++H2O===Al(OH)3↓,
Al(OH)3+3H+===Al3++3H2O。