




1.碳和硅在自然界中以什么形式存在?
2.CO2的物理性质:是一种 色 体, 溶于水,固态CO2俗称 。
3.完成以下方程式:
(1)CO2 + H2O →
(2)CO2 + NaOH →
(3)CO2 + CaO →
4.请写出硅原子和碳原子的原子结构示意图。
5.根据Na2CO3+SiO2Na2SiO3+CO2↑能说明硅酸酸性比碳酸强吗?
6.由于SiO2既可与碱反应,也可与氢氟酸反应,所以SiO2为两性氧化物,这种说法是否正确?
【答案】
1.碳在自然界中有游离态和化合态两种形式存在,硅在自然界中以化合态存在。
2.无色无味 气体 能 干冰
3.(1)CO2 + H2O = H2CO3
(2)CO2 + 2NaOH = Na2CO3+H2O
(3)CO2 + CaO = CaCO3
4.
【新知精讲】
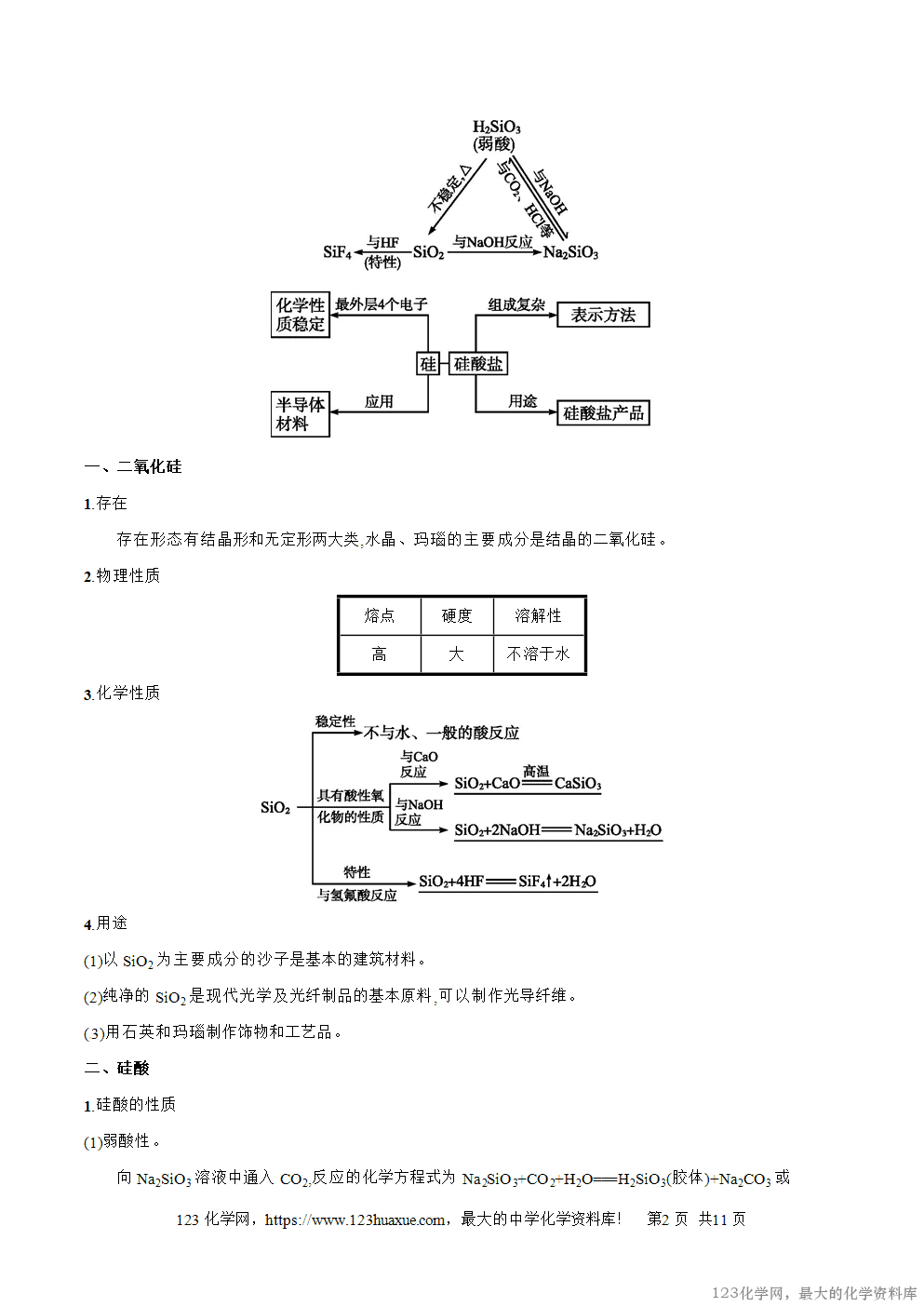
一、二氧化硅
1.存在
存在形态有结晶形和无定形两大类,水晶、玛瑙的主要成分是结晶的二氧化硅。
2.物理性质
熔点
硬度
溶解性
高
大
不溶于水
3.化学性质
4.用途
(1)以SiO2为主要成分的沙子是基本的建筑材料。
(2)纯净的SiO2是现代光学及光纤制品的基本原料,可以制作光导纤维。
(3)用石英和玛瑙制作饰物和工艺品。
二、硅酸
1.硅酸的性质
(1)弱酸性。
向Na2SiO3溶液中通入CO2,反应的化学方程式为Na2SiO3+CO2+H2O===H2SiO3(胶体)+Na2CO3或Na2SiO3+2CO2+2H2O===H2SiO3(胶体)+2NaHCO3。
结论:H2SiO3酸性比H2CO3酸性弱。
(2)不稳定性。
H2SiO3受热易分解,化学方程式为H2SiO3SiO2+H2O。
2.硅酸的制备
(1)Na2SiO3溶液与CO2的反应:Na2SiO3+CO2+H2O===H2SiO3(胶体)+Na2CO3。
(2)Na2SiO3与盐酸的反应:Na2SiO3+2HCl===H2SiO3(胶体)+2NaCl。
3.硅酸的存在及用途
(1)浓度小时:形成硅酸溶胶。
(2)浓度大时:形成硅酸凝胶。
(3)硅胶。
硅酸凝胶经干燥脱水得到的硅酸干凝胶,称为“硅胶”,具有很强的吸水性,常用作干燥剂或催化剂的载体。