



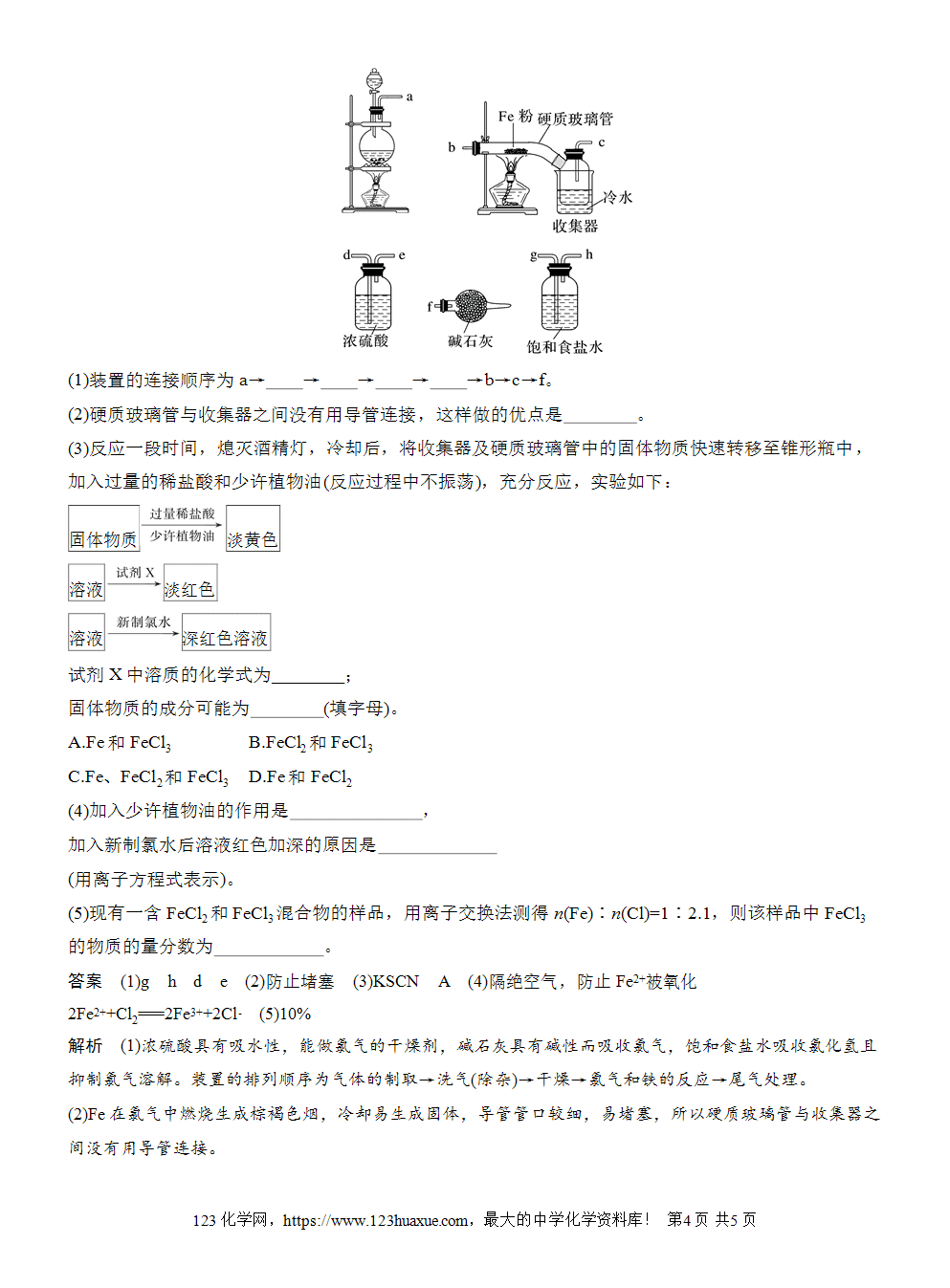

实验活动2 铁及其化合物的性质
【实验目的】
1.认识铁及其化合物的重要化学性质。
2.学会铁离子的检验方法。
3.认识可通过氧化还原反应实现含有不同价态同种元素的物质间的相互转化。
【实验用品】
试管、胶头滴管、药匙、镊子。
CuSO4溶液、FeCl3稀溶液、FeCl2溶液、FeSO4溶液、酸性KMnO4溶液、KSCN溶液、KI溶液、淀粉溶液、蒸馏水、锌片、铜片、铁粉、铁丝。
【实验步骤】
1.铁单质的还原性
在一支试管中加入2 mL CuSO4溶液,再将一段铁丝放入CuSO4溶液中。过一会儿,取出铁丝,观察到的现象是铁丝表面有红色固体析出。化学方程式:CuSO4+Fe===FeSO4+Cu。
2.铁盐的氧化性
(1)取3 mL FeCl3稀溶液加入试管中,加入几小块铜片,振荡,过一会儿,观察到的现象是铜片被腐蚀,溶液由棕黄色变为蓝绿色,化学方程式:Cu+2FeCl3===2FeCl2+CuCl2。
(2)在一支盛有3 mL水的试管中滴加几滴FeCl3稀溶液,再滴加3滴KI溶液,观察到的现象是溶液由淡黄色变成棕色,然后向溶液中滴加2滴淀粉溶液,溶液变蓝,离子方程式:2Fe3++2I-===2Fe2++I2。
3.亚铁盐的氧化性和还原性
(1)取3 mL FeCl2溶液加入试管中,加入几小块锌片,振荡,过一会儿,观察到的现象是溶液变为无色,化学方程式:FeCl2+Zn===ZnCl2+Fe。
(2)在一支试管中加入少量酸性KMnO4溶液,然后向试管中加入少量FeSO4溶液,观察溶液的颜色变化。当溶液紫色褪去时,再滴加2滴KSCN溶液,观察到的现象是溶液变红色,化学方程式:10FeSO4+2KMnO4+8H2SO4===5Fe2(SO4)3+2MnSO4+8H2O+K2SO4、Fe2(SO4)3+6KSCN===2Fe(SCN)3+3K2SO4。
4.铁离子的检验
(1)在一支试管中加入2 mL蒸馏水,再滴加几滴FeCl3稀溶液,然后滴加几滴KSCN溶液,观察到的现象是溶液变红色。
(2)在一支试管中加入少量FeCl3稀溶液,然后加入适量铁粉,轻轻振荡片刻,溶液变浅绿色,再滴加几滴KSCN溶液,溶液无明显变化。化学方程式:2FeCl3+Fe===3FeCl2。
【问题和讨论】
1.根据以上的实验及所学的知识,以铁屑为原料,制备硫酸亚铁溶液时应该注意什么?
提示 由于Fe2+易被氧化,所以在制备过程中要保证铁屑过量。
2.若向FeCl3稀溶液中加入过量锌粉,溶液中存在的阳离子是哪种金属离子?原因是什么?
提示 Zn2+,锌的活泼性比铁强,所以过量锌粉可以把Fe3+还原为铁单质。
3.由以上实验思考检验Fe2(SO4)3溶液中是否有杂质FeSO4的方法?
提示 在一支试管中加入少量酸性KMnO4溶液,然后向试管中滴加Fe2(SO4)3溶液,若酸性KMnO4溶液紫色褪去,则说明含有FeSO4杂质,反之则无。
1.(2025·吉林农安高一期末)下列实验操作、现象及结论均正确的是( )