




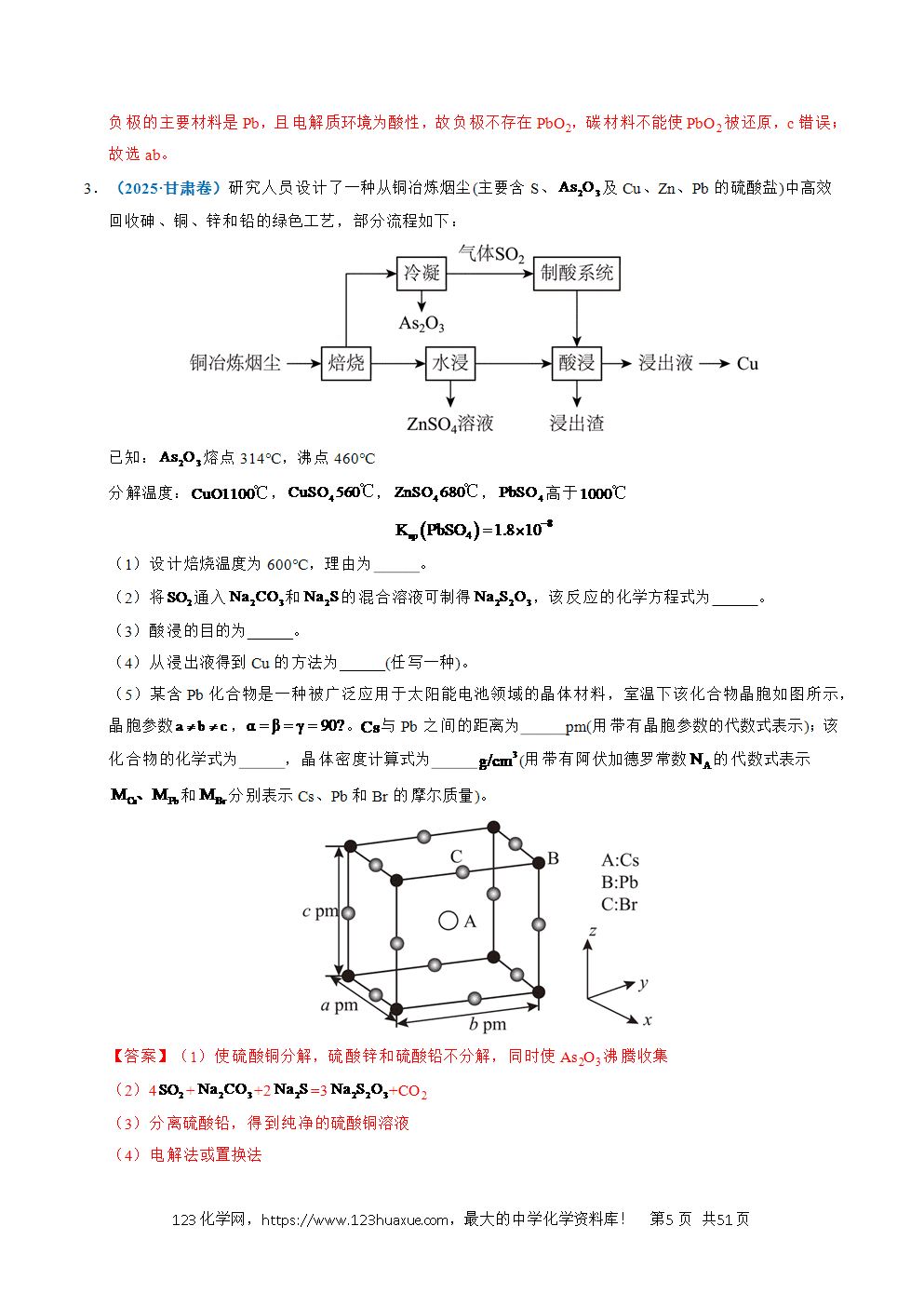


















1.(2025·安徽卷)某含锶()废渣主要含有和等,一种提取该废渣中锶的流程如下图所示。
已知时,
回答下列问题:
(1)锶位于元素周期表第五周期第ⅡA族。基态原子价电子排布式为 。
(2)“浸出液”中主要的金属离子有、 (填离子符号)。
(3)“盐浸”中转化反应的离子方程式为 ;时,向粉末中加入溶液,充分反应后,理论上溶液中 (忽略溶液体积的变化)。
(4)其他条件相同时,盐浸,浸出温度对锶浸出率的影响如图1所示。随温度升高锶浸出率增大的原因是 。
(5)“浸出渣2”中主要含有、 (填化学式)。
(6)将窝穴体a(结构如图2所示)与形成的超分子加入“浸出液”中,能提取其中的,原因是 。
(7)由制备无水的最优方法是 (填标号)。
a.加热脱水 b.在气流中加热 c.常温加压 d.加热加压
【答案】(1)
(2)、
(3)
(4)升高温度,与有效碰撞次数增加,反应速率加快,所以锶浸出率增大;
(5)、
(6)窝穴体a的空腔与更匹配,可通过分子间相互作用形成超分子,且具有更多的空轨道,能够与更多的N、O形成配位键,形成超分子后,结构更稳定
(7)a
【分析】含锶()废渣主要含有和等,加入稀盐酸酸浸,碳酸盐溶解进入滤液,浸出渣1中含有,加入溶液,发生沉淀转化,,得到溶液,经过系列操作得到晶体;
【解析】(1)锶位于元素周期表第五周期第ⅡA族,基态原子价电子排布式为;
(2)由分析可知,碳酸盐均能溶于盐酸,“浸出液”中主要的金属离子有、、;
(3)由分析可知,“盐浸”中发生沉淀的转化,离子方程式:;该反应的平衡常数,平衡常数很大,近似认为完全转化,溶液中剩余,则,列三段式:,理论上溶液中;
(4)随温度升高锶浸出率增大,原因是升高温度,与有效碰撞次数增加,反应速率加快,所以锶浸出率增大;
(5)“盐浸”时发生沉淀的转化,生成了,不参与反应,故浸出渣2”中主要含有、、;
(6)窝穴体a与形成的超分子加入“浸出液”中,能提取其中的,原因是窝穴体a的空腔与更匹配,可通过分子间相互作用形成超分子,且具有更多的空轨道,能够与更多的N、O形成配位键,形成超分子后,结构更稳定;
(7)为强碱,则也是强碱,不水解,排除b,由平衡移动原理可知制备无水的方法加压不利于脱水,排除c、d,故选a。
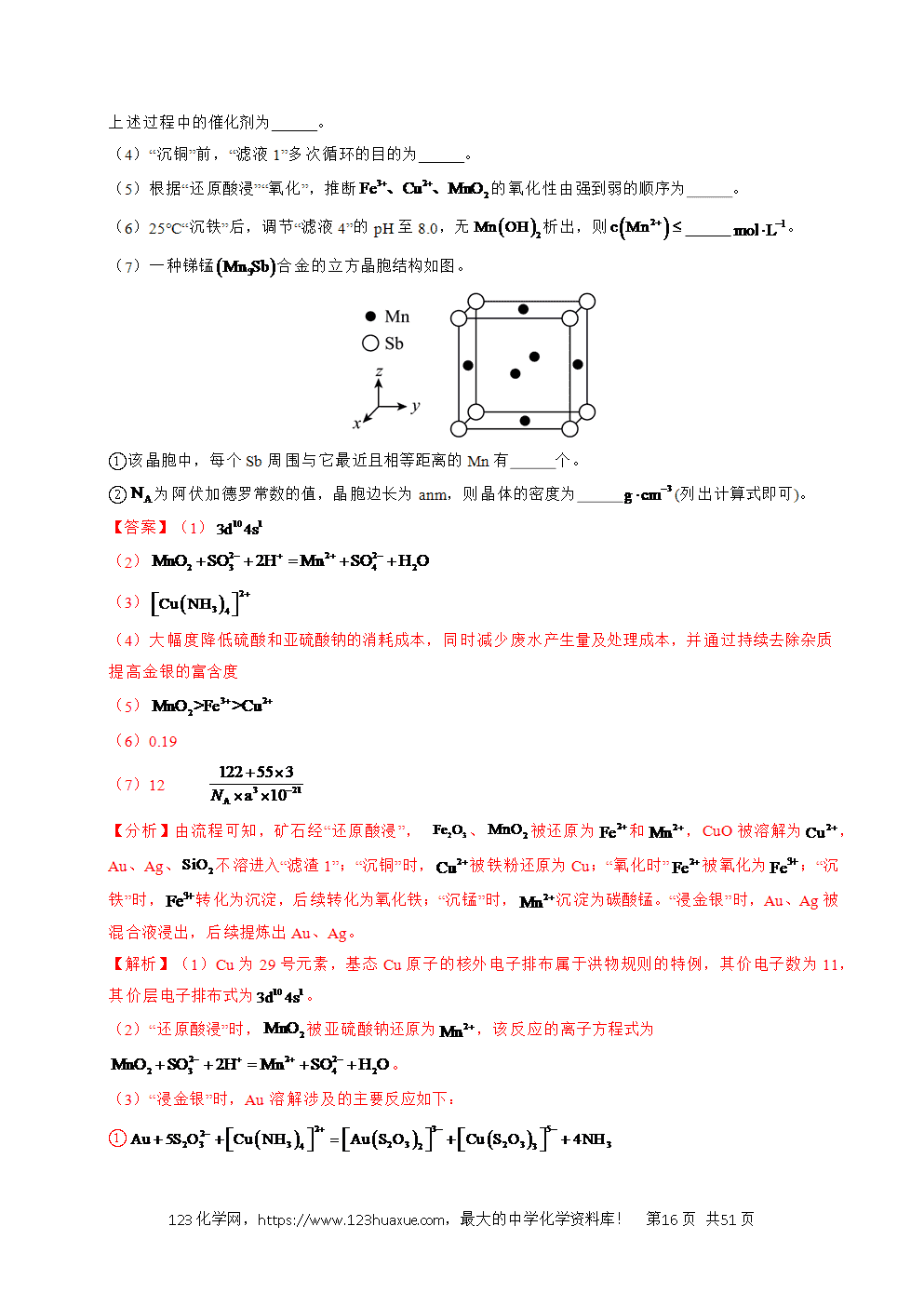
2.(2025·北京卷)铅酸电池是用途广泛并不断发展的化学电源。
(1)十九世纪,铅酸电池工作原理初步形成并延续至今。
铅酸电池工作原理:
①充电时,阴极发生的电极反应为 。
②放电时,产生a库仑电量,消耗的物质的量为 。已知:转移电子所产生的电量为96500库仑。
③作为电解质溶液性质稳定、有较强的导电能力,参与电极反应并有利于保持电压稳定。该体系中不氧化,氧化性弱与其结构有关,的空间结构是 。
④铅酸电池储存过程中,存在化学能的缓慢消耗:电极在作用下产生的可将电极氧化。氧化发生反应的化学方程式为 。
(2)随着铅酸电池广泛应用,需要回收废旧电池材料,实现资源的再利用。回收过程中主要物质的转化关系示意图如下。
①将等物质转化为的过程中,步骤I加入溶液的目的是 。
②步骤Ⅱ、Ⅲ中和作用分别是 。
(3)铅酸电池使用过程中,负极因生成导电性差的大颗粒,导致电极逐渐失活。通过向负极添加石墨、多孔碳等碳材料,可提高铅酸电池性能。碳材料的作用有 (填序号)。
a.增强负极导电性
b.增大负极材料比表面积,利于生成小颗粒
c.碳材料作还原剂,使被还原
【答案】(1) 正四面体形
(2)使硫酸铅转化为氢氧化铅,便于后续的溶解 H2O2的作用为还原剂,K2S2O8的作用为氧化剂
(3)ab
【解析】(1)①充电时,阴极发生还原反应,PbSO4得到电子变成Pb,其发生的电极反应为:;
②根据放电时的反应,每消耗1molH2SO4,转移1mol电子;产生a库伦电量,转移的电子为,故消耗H2SO4的物质的量为;
③的中心原子S原子的价层电子对数为,故其空间结构为正四面体形;
④Pb在H2SO4作用下与氧气反应,会生成PbSO4和水,反应的化学方程式为:。
(2)废旧铅酸电池通过预处理得到PbSO4、PbO、PbO2;加入NaOH,使PbSO4转化为Pb(OH)2,过滤得到Pb(OH)2、PbO、PbO2;若加入H2O2,在酸性条件下生成含Pb2+溶液,电解后生成Pb;若加入K2S2O8,在碱性条件下可生成PbO2。
①由以上分析可知,加入NaOH,使PbSO4转化为Pb(OH)2,过滤得到Pb(OH)2、PbO、PbO2,其目的是为了使硫酸铅转化为氢氧化铅,便于后续的溶解;
②由以上分析可知,加入H2O2,在酸性条件下生成含Pb2+溶液,说明PbO2被H2O2还原,故H2O2的作用为还原剂;加入K2S2O8,在碱性条件下可生成PbO2,说明Pb(OH)2、PbO被K2S2O8氧化,故K2S2O8的作用为氧化剂。
(3)由于负极会生成导电性差的大颗粒PbSO4,石墨可以导电,多孔碳可以增加负极材料的比表面积,故碳材料的作用可以增强负极的导电性,且有利于生成小颗粒PbSO4,故a、b正确;
负极的主要材料是Pb,且电解质环境为酸性,故负极不存在PbO2,碳材料不能使PbO2被还原,c错误;
故选ab。