
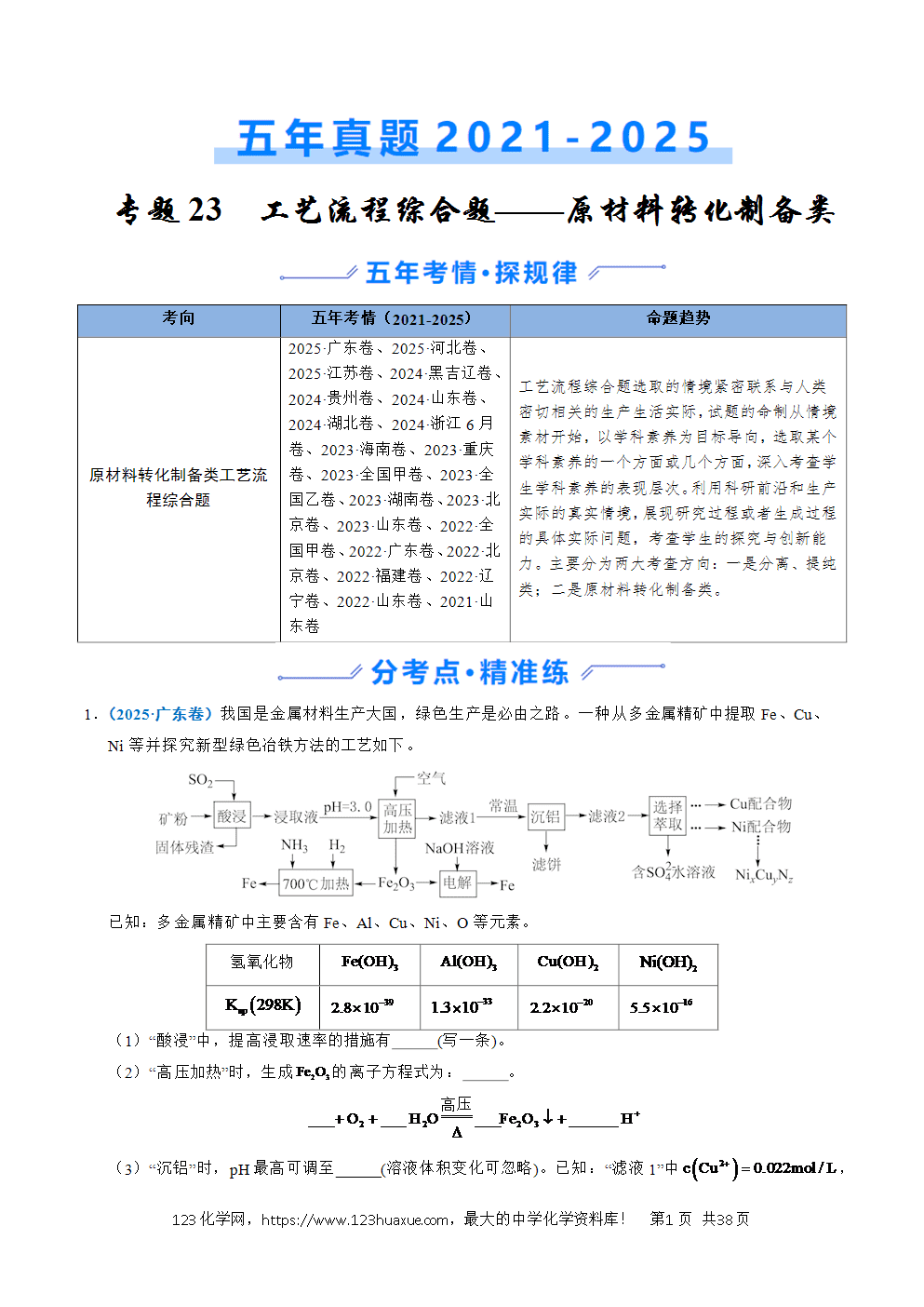
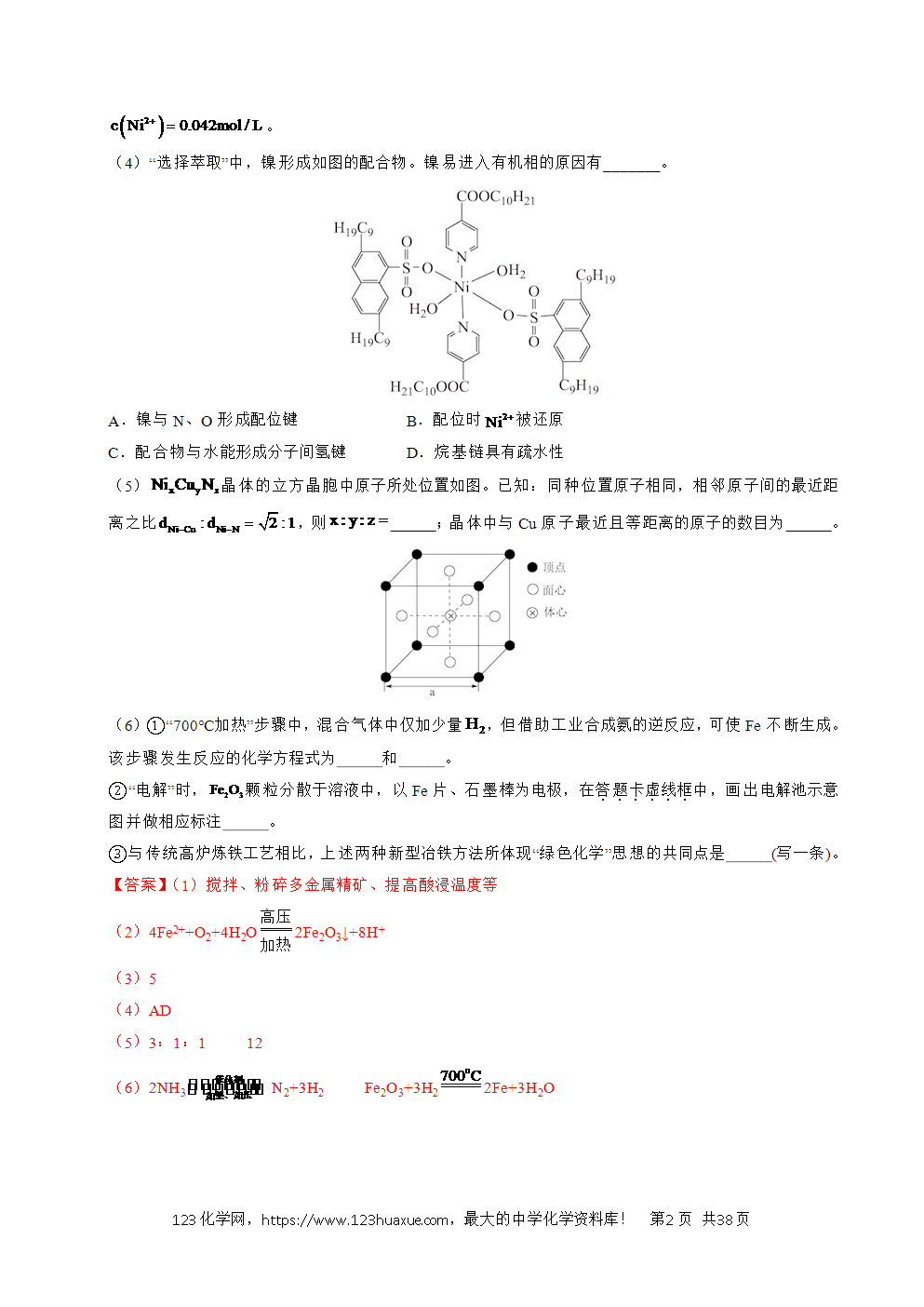


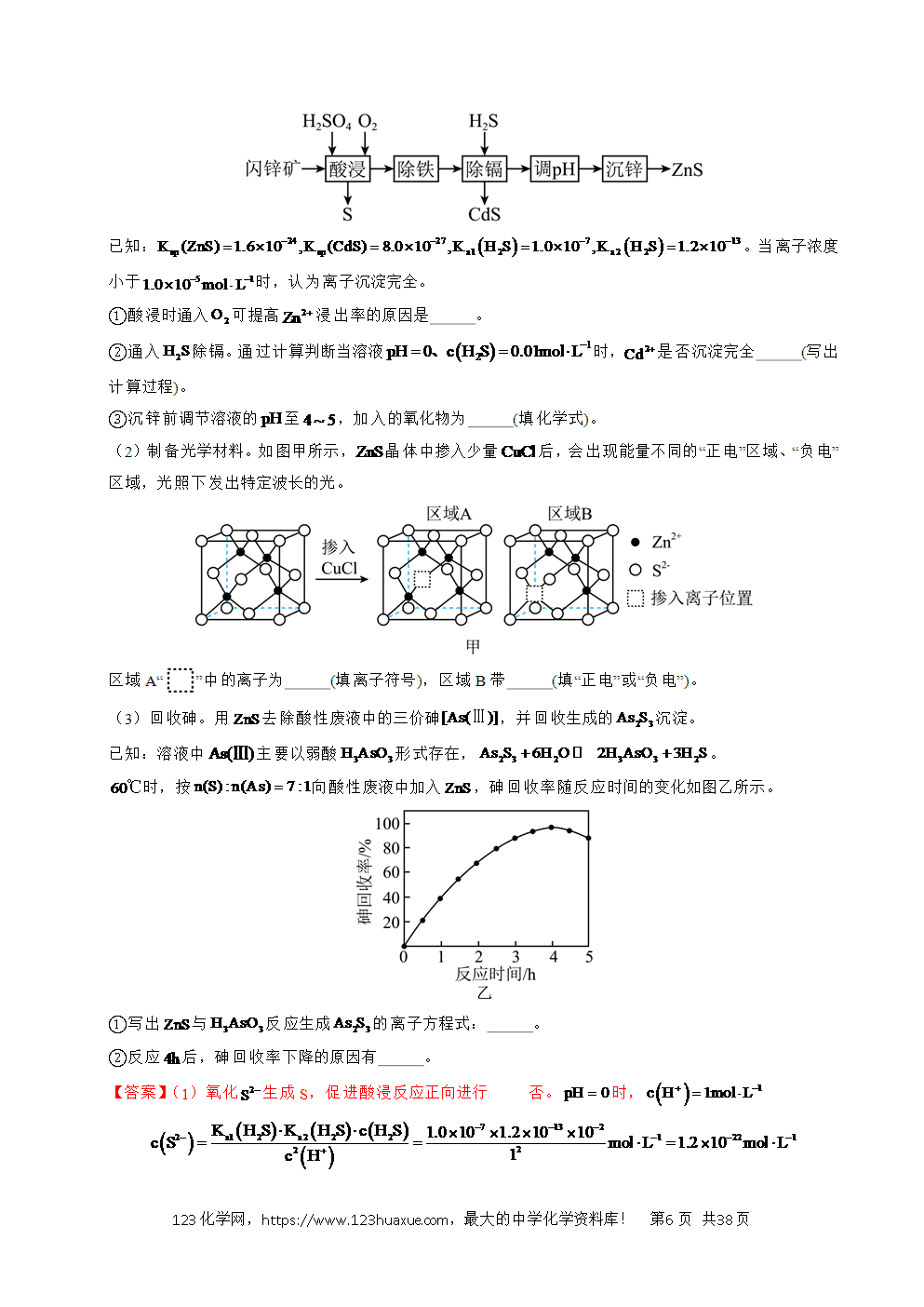



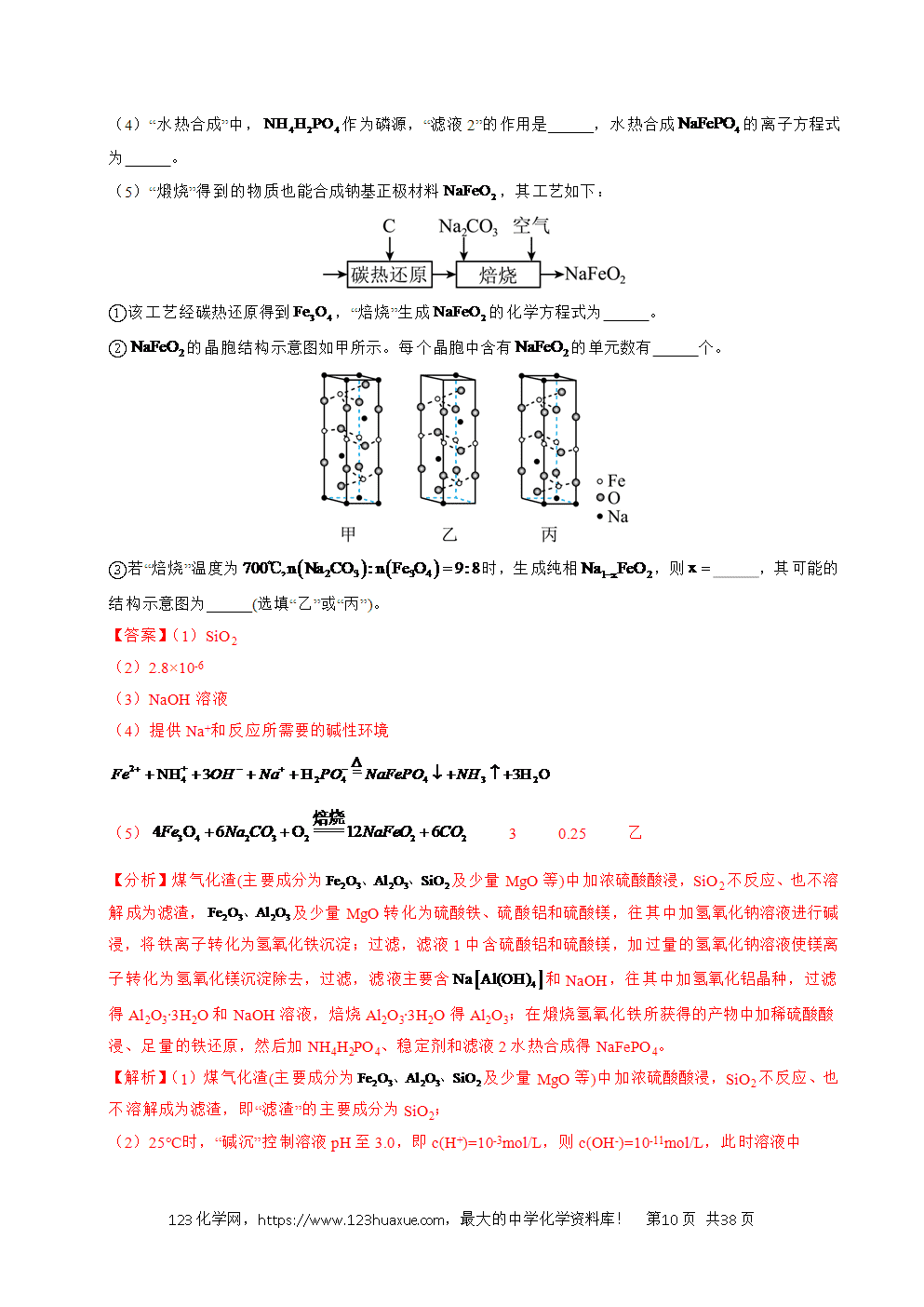



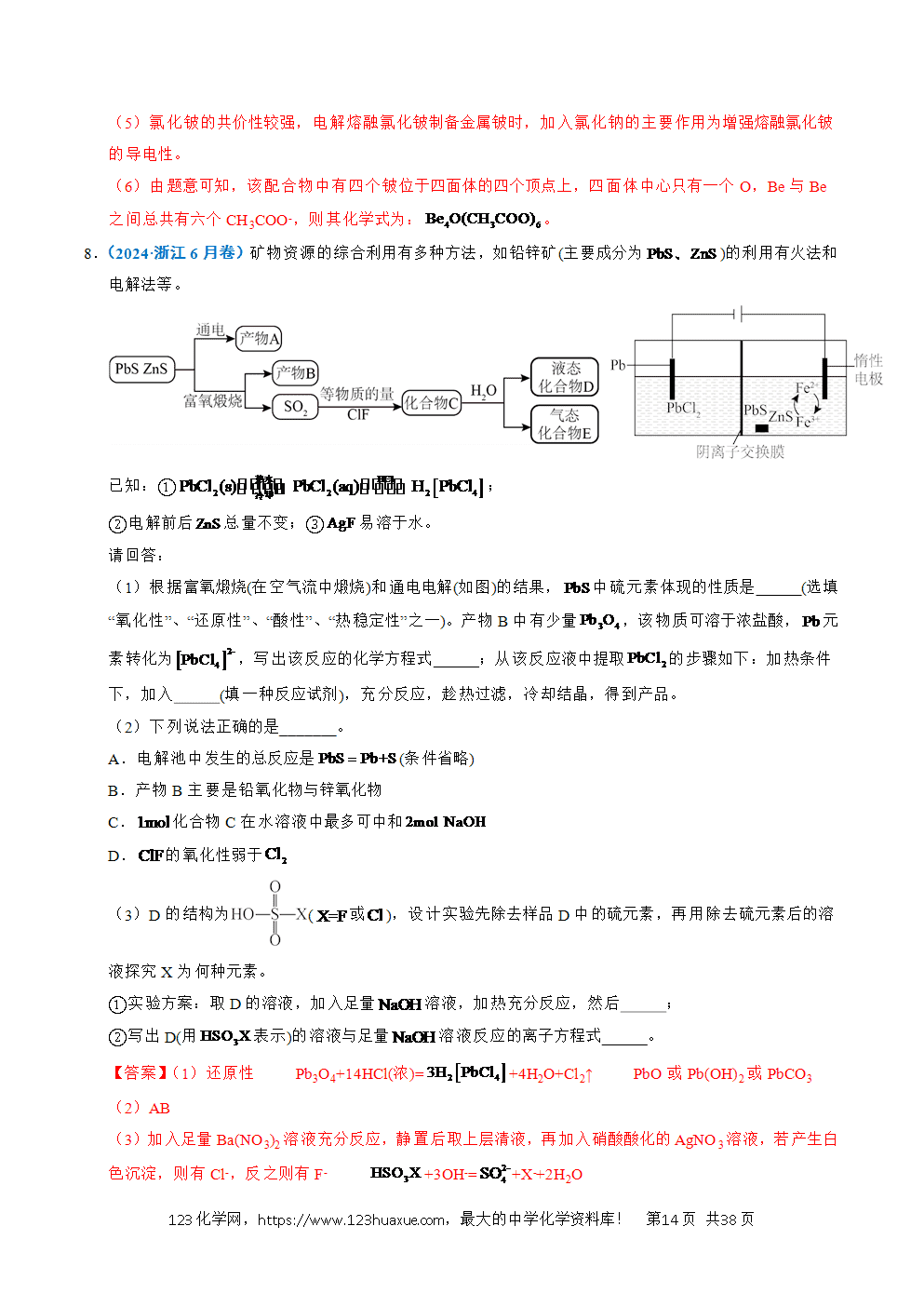






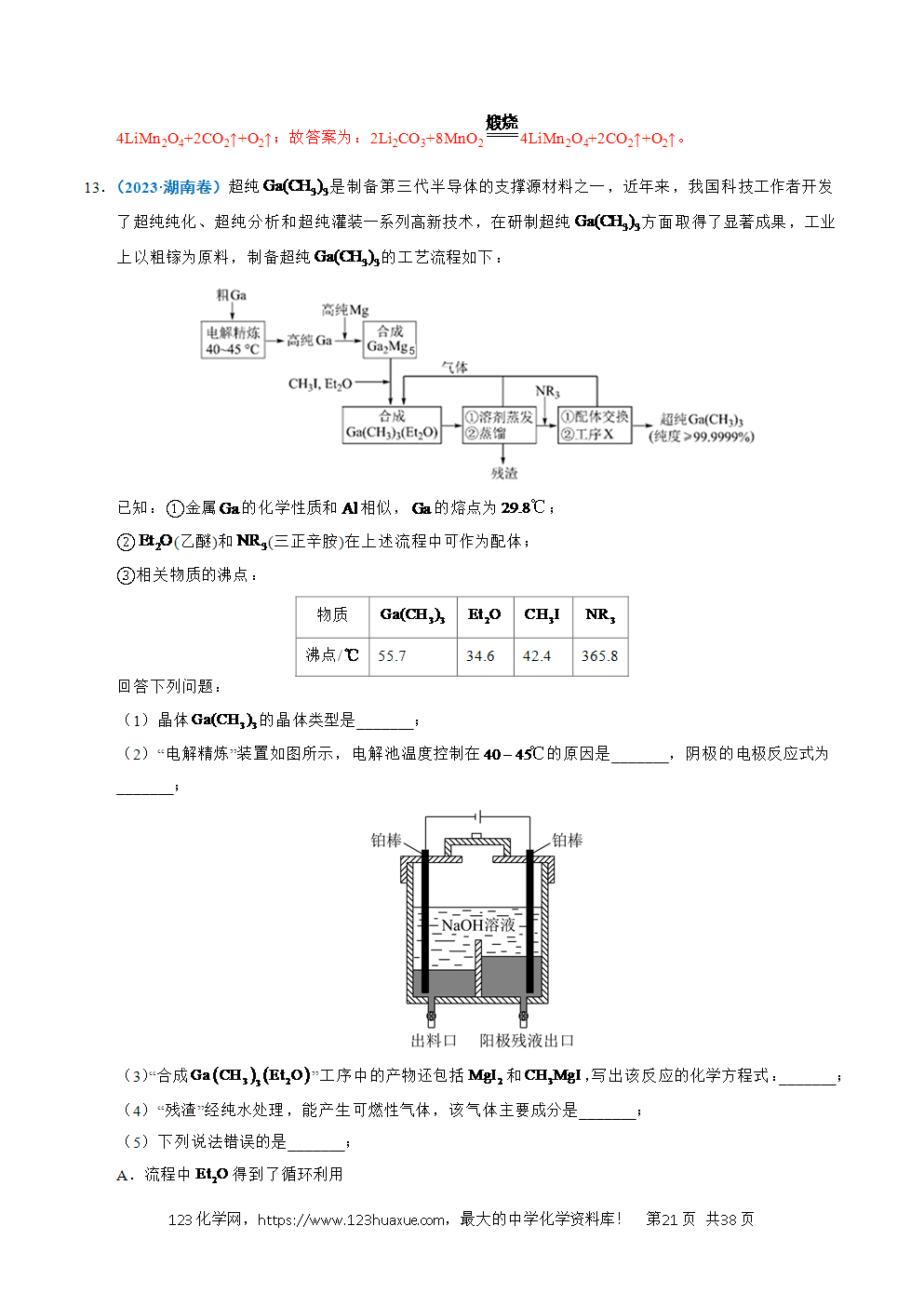



工艺流程综合题选取的情境紧密联系与人类密切相关的生产生活实际,试题的命制从情境素材开始,以学科素养为目标导向,选取某个学科素养的一个方面或几个方面,深入考查学生学科素养的表现层次。利用科研前沿和生产实际的真实情境,展现研究过程或者生成过程的具体实际问题,考查学生的探究与创新能力。主要分为两大考查方向:一是分离、提纯类;二是原材料转化制备类。
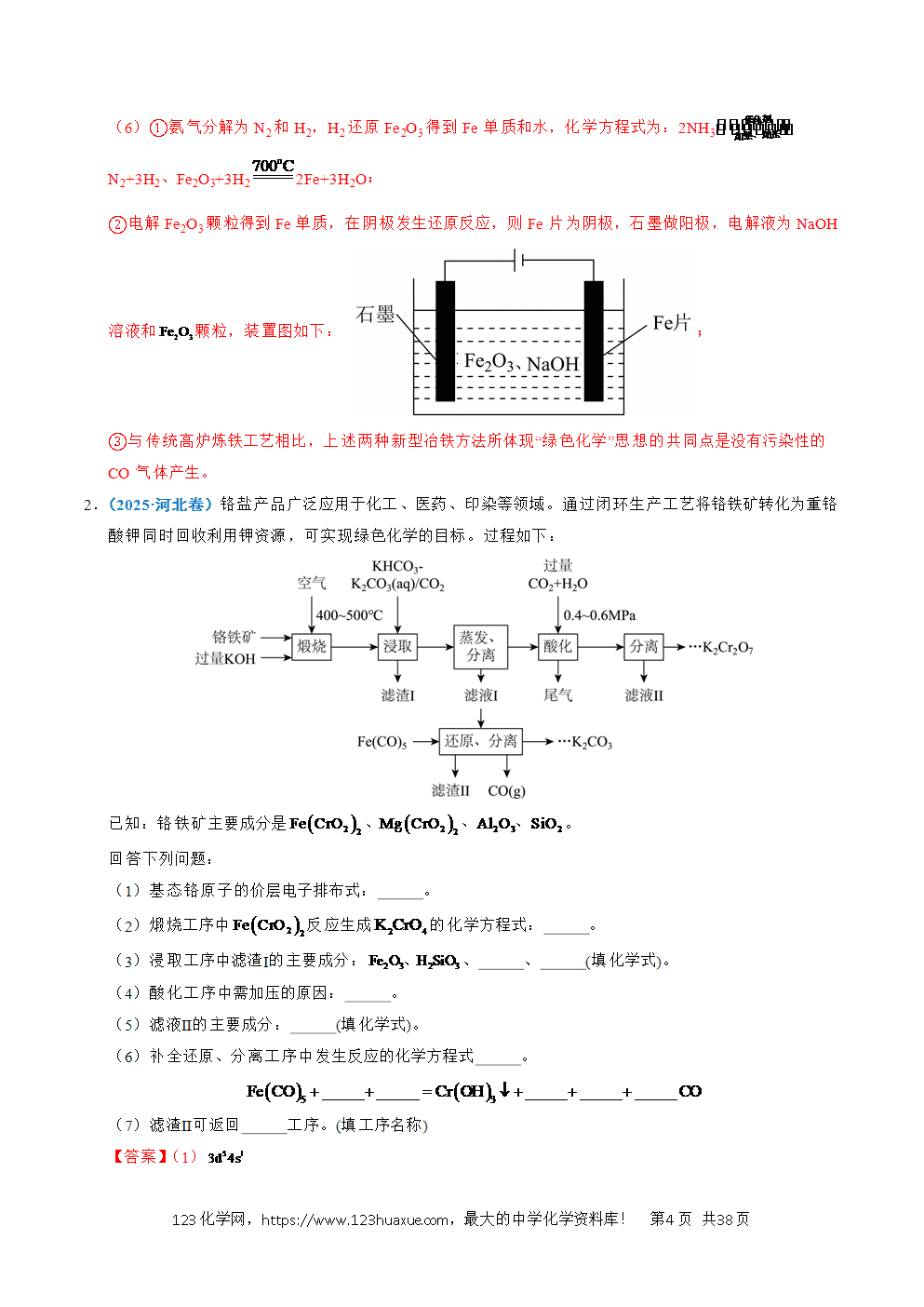
(2025·河北卷)铬盐产品广泛应用于化工、医药、印染等领域。通过闭环生产工艺将铬铁矿转化为重铬酸钾同时回收利用钾资源,可实现绿色化学的目标。过程如下:
已知:铬铁矿主要成分是。
回答下列问题:
(1)基态铬原子的价层电子排布式: 。
(2)煅烧工序中反应生成的化学方程式: 。
(3)浸取工序中滤渣Ⅰ的主要成分:、 、 (填化学式)。
(4)酸化工序中需加压的原因: 。
(5)滤液Ⅱ的主要成分: (填化学式)。
(6)补全还原、分离工序中发生反应的化学方程式 。
(7)滤渣Ⅱ可返回 工序。(填工序名称)
【答案】(1)
(2)
(3) MgO
(4)增大CO2的溶解度,保证酸化反应充分进行
(5)
(6)
(7)煅烧
【分析】铬铁矿主要成分是,与过量KOH在空气中煅烧,生成、Fe2O3、MgO,;通入/CO2浸取,生成,、MgO不反应,故滤渣Ⅰ为:,、MgO,通过蒸发浓缩、冷却结晶、过滤分离出固体,滤液Ⅰ中含有;将中加水溶解,并通入过量CO2酸化,将转化为,同时副产物生成,将与分离,滤液Ⅱ的主要溶质为;做还原剂,将滤液Ⅰ中剩余的还原为,自身转化为进入滤渣Ⅱ,KOH进一步处理得,循环使用,据此分析;
【解析】(1)Cr为24号元素,基态铬原子的价层电子排布式:;
(2)煅烧工序中与过量KOH、空气中氧气反应生成、Fe2O3、,根据得失电子守恒,原子守恒,化学方程式:;
(3)根据分析可知,滤渣Ⅰ的主要成分:、MgO;
(4)向中加水溶解,并通入过量CO2酸化,将转化为,加大压强,可以增大CO2的溶解度,使液体中CO2浓度增大,保证酸化反应充分进行;
(5)根据分析可知,滤液Ⅱ的主要溶质为;
(6)做还原剂,将滤液Ⅰ中剩余的还原为,自身转化为,铁元素由0价升高到+3价,Cr由+6价降低到+3价,根据得失电子守恒,原子守恒,化学方程式:;
(7)滤渣Ⅱ含有和可返回煅烧工序。