



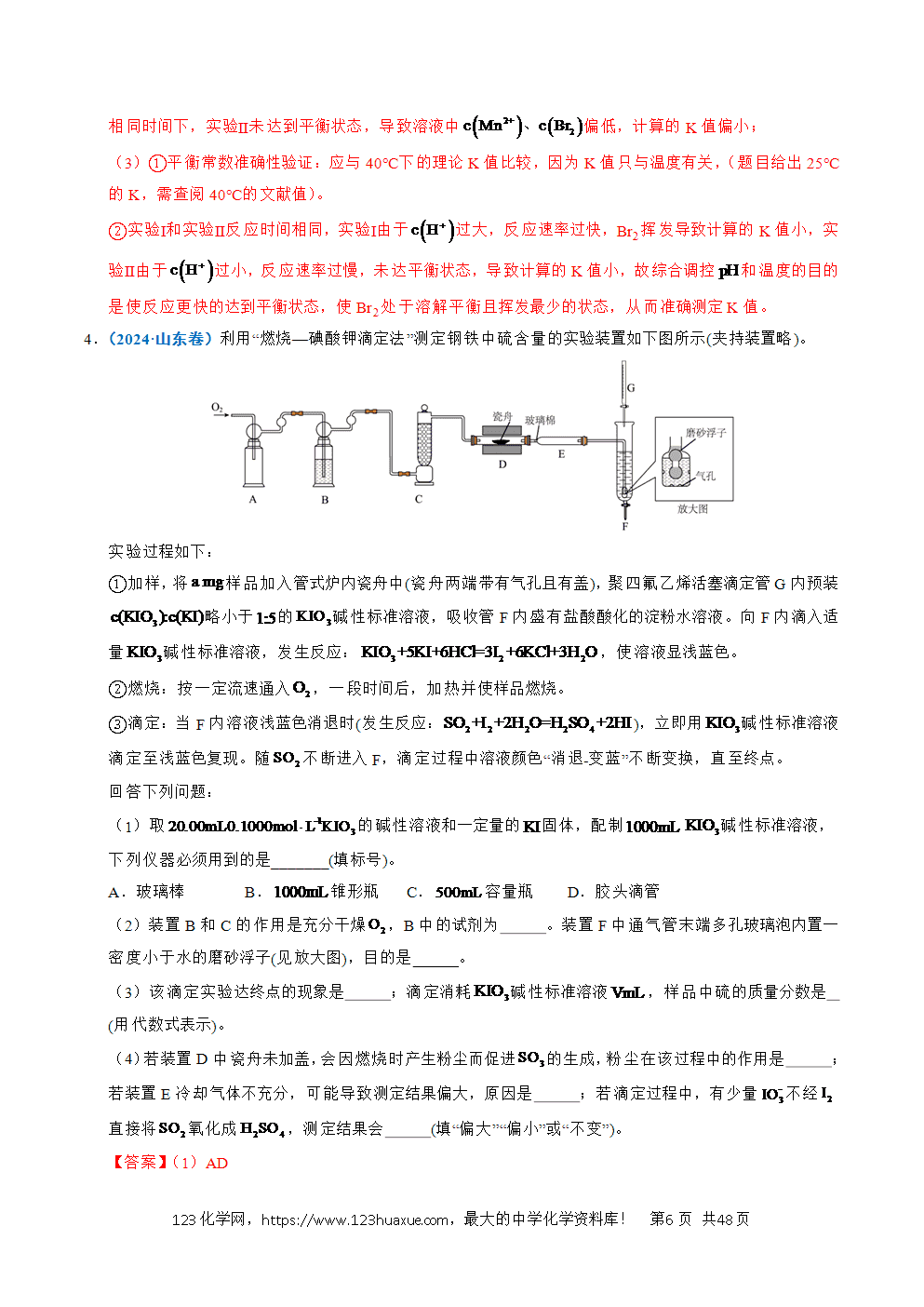










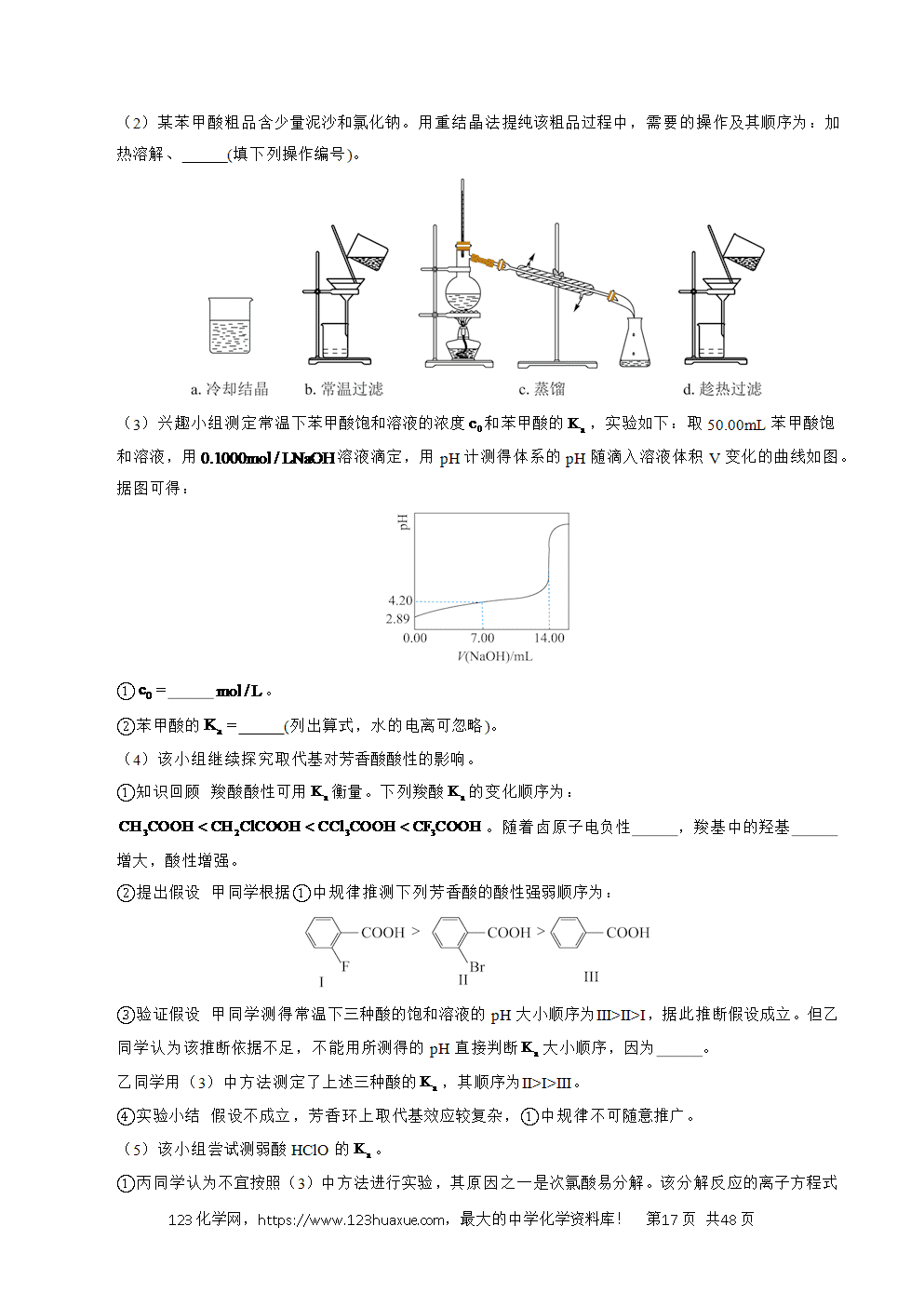

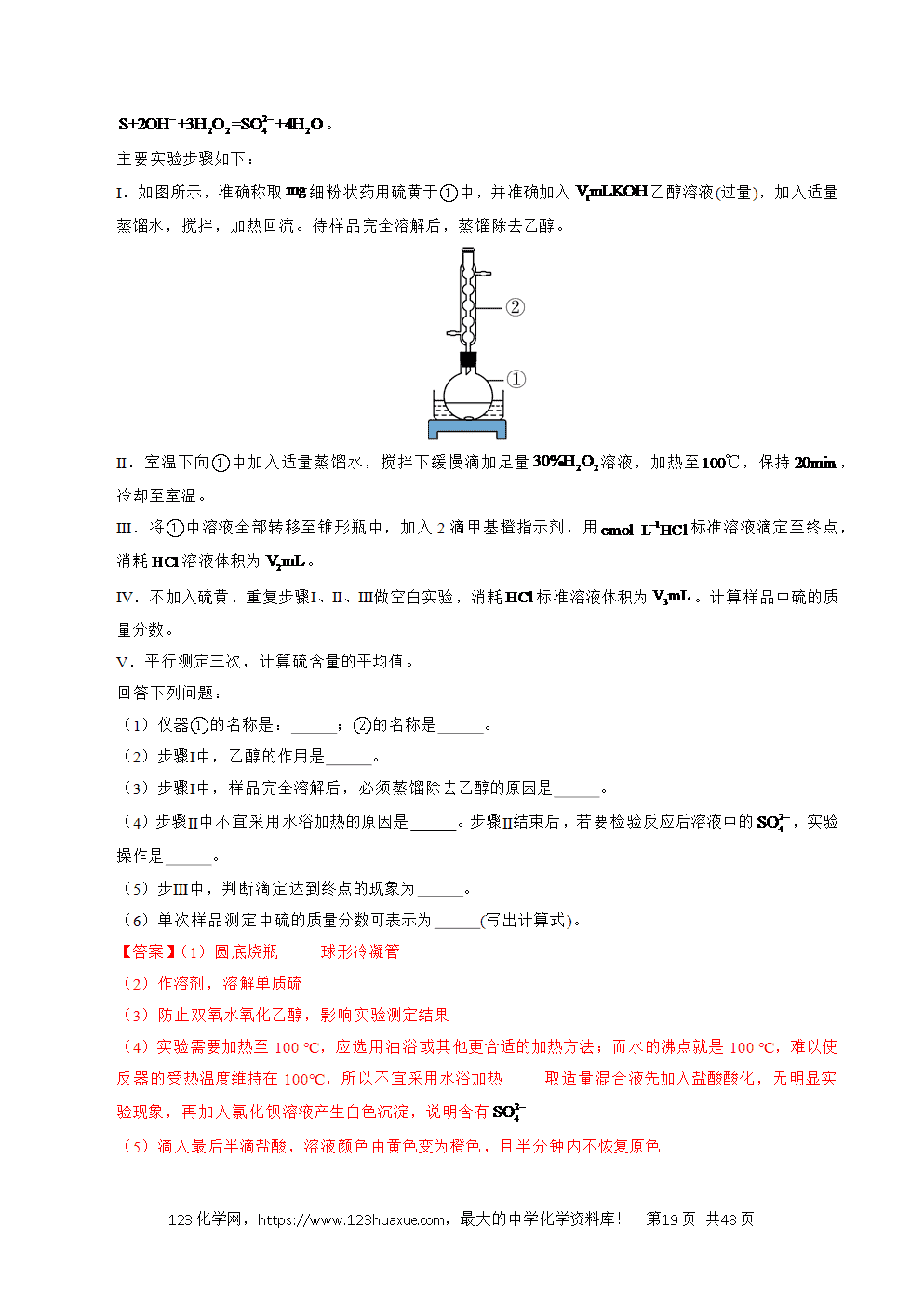




1.(2025·湖北卷)某小组在探究的还原产物组成及其形态过程中,观察到的实验现象与理论预测有差异。根据实验描述,回答下列问题:
(1)向溶液加入5滴溶液,振荡后加入葡萄糖溶液,加热。
①反应产生的砖红色沉淀为 (写化学式),葡萄糖表现出 (填“氧化”或“还原”)性。
②操作时,没有加入葡萄糖溶液就加热,有黑色沉淀生成。用化学反应方程式说明该沉淀产生的原因: 。
(2)向溶液中加入粉使蓝色完全褪去,再加入盐酸并加热至溶液中无气泡产生为止。过滤得固体,洗涤并真空干燥。
①加入盐酸的目的是
②同学甲一次性加入粉,得到红棕色固体,其组成是 (填标号)。
a. b.包裹 c. d.和
③同学乙搅拌下分批加入粉,得到黑色粉末X。分析结果表明,X中不含和。关于X的组成提出了三种可能性:Ⅰ ;Ⅱ 和;Ⅲ ,开展了下面2个探究实验:
由实验结果可知,X的组成是 (填“Ⅰ”“Ⅱ”或“Ⅲ”)。从物质形态角度分析,X为黑色的原因是 。
【答案】(1)Cu2O 还原
(2)除去过量的锌粉 b Ⅲ 光线进入后被多次反射吸收,所以呈黑色
【分析】(1)向溶液加入5滴溶液,制得新制氢氧化铜悬浊液,振荡后加入葡萄糖溶液,加热,新制氢氧化铜悬浊液和葡萄糖中的醛基反应;
(2)向溶液中加入粉使蓝色完全褪去,Cu2+全部被还原,再加入盐酸并加热至溶液中无气泡产生为止,过量的Zn粉全部转化为Zn2+,过滤得固体,洗涤并真空干燥,该固体是Cu2+的还原产物,可能含Cu、Cu2O等。
【解析】(1)①向溶液加入5滴溶液制得新制氢氧化铜悬浊液,振荡后加入葡萄糖溶液,加热,新制氢氧化铜悬浊液与葡萄糖中的醛基反应产生的砖红色沉淀为Cu2O,Cu被葡萄糖从+2价还原为+1价,葡萄糖表现出还原性;
②操作时,没有加入葡萄糖溶液就加热,有黑色沉淀生成,该黑色沉淀为CuO,用化学反应方程式说明该沉淀产生的原因:;
(2)①由题干加入盐酸并加热至溶液中无气泡产生为止可知加入盐酸的作用是除去过量的锌粉;
②先加Zn粉、后加盐酸,得到固体为红棕色,则一定有Cu(Cu2O和HCl发生歧化反应生成Cu),20mL 0.5mol/LCuSO4中n(Cu2+)=0.5mol/L×20mL=0.01mol,Cu的最大物质的量为0.01mol,质量为0.64g,生成Cu2O的最大质量为0.72g,实际固体质量为0.78g:
a.若只有Cu,则固体质量应小于等于0.64g,a不符题意;
b.若是Cu包裹Zn,则0.64<固体质量<1.18g,b符合题意;
c.若是CuO,则不可能为红棕色,c不符题意;
d.若是Cu和Cu2O,固体质量应介于0.64g—0.72g之间,d不符题意;
选b;
③实验1得到的溶液呈无色,说明一定无CuO,那么X的组成只能是Cu,选Ⅲ;从物质形态角度分析,X为黑色的原因是金属固体Cu呈粉末状时,光线进入后被多次反射吸收,所以呈黑色。
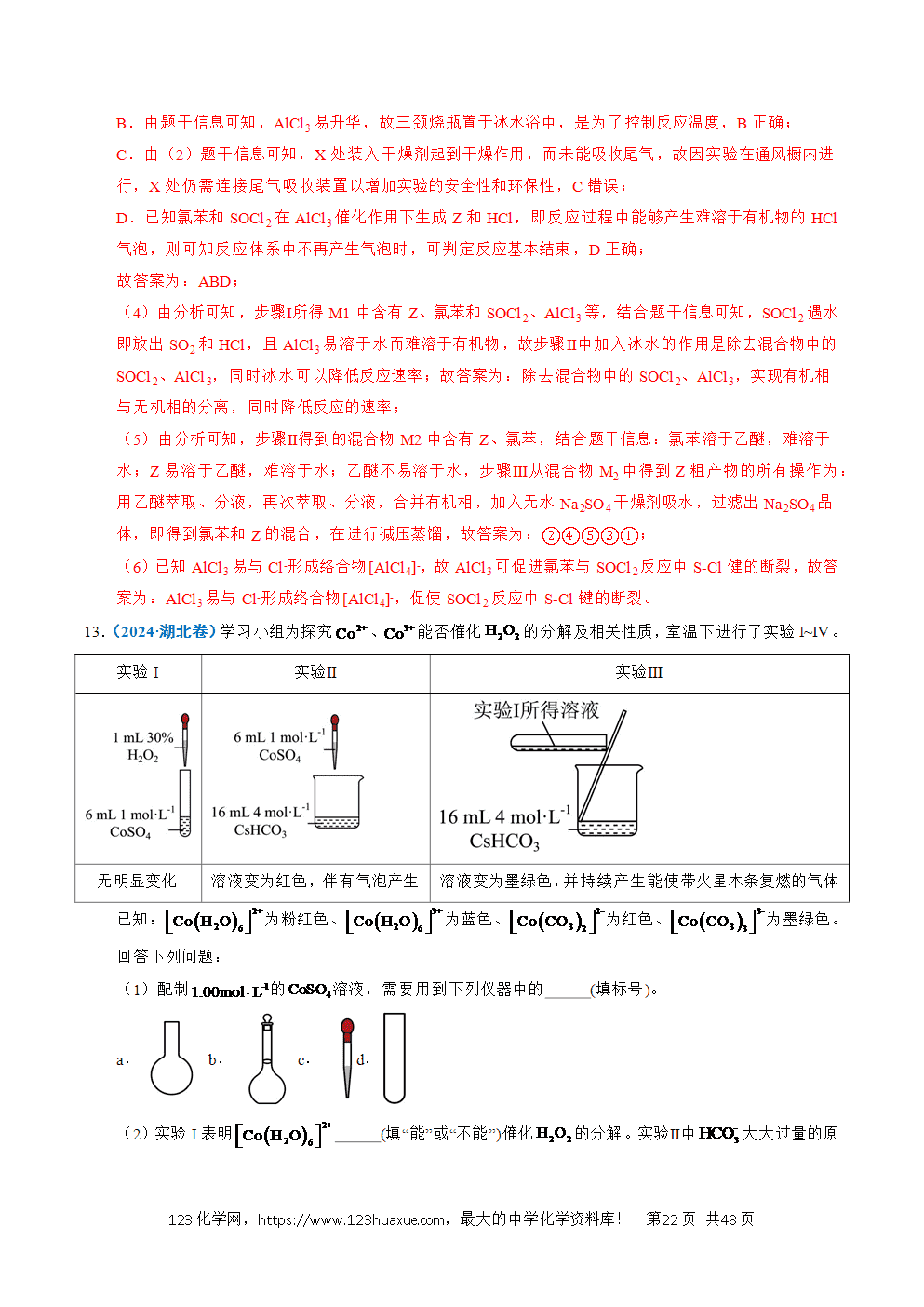
2.(2025·江苏卷)海洋出水铁质文物表面有凝结物,研究其形成原理和脱氯方法对保护文物意义重大。
(1)文物出水清淤后,须尽快浸泡在稀或溶液中进行现场保护。
①玻璃中的能与反应生成 (填化学式),故不能使用带磨口玻璃塞的试剂瓶盛放溶液。
②文物浸泡在碱性溶液中比暴露在空气中能减缓吸氧腐蚀,其原因有 。
(2)文物表面凝结物种类受文物材质和海洋环境等因素的影响。
①无氧环境中,文物中的与海水中的在细菌作用下形成等含铁凝结物。写出与反应生成和的离子方程式: 。
②有氧环境中,海水中的铁质文物表面形成等凝结物。
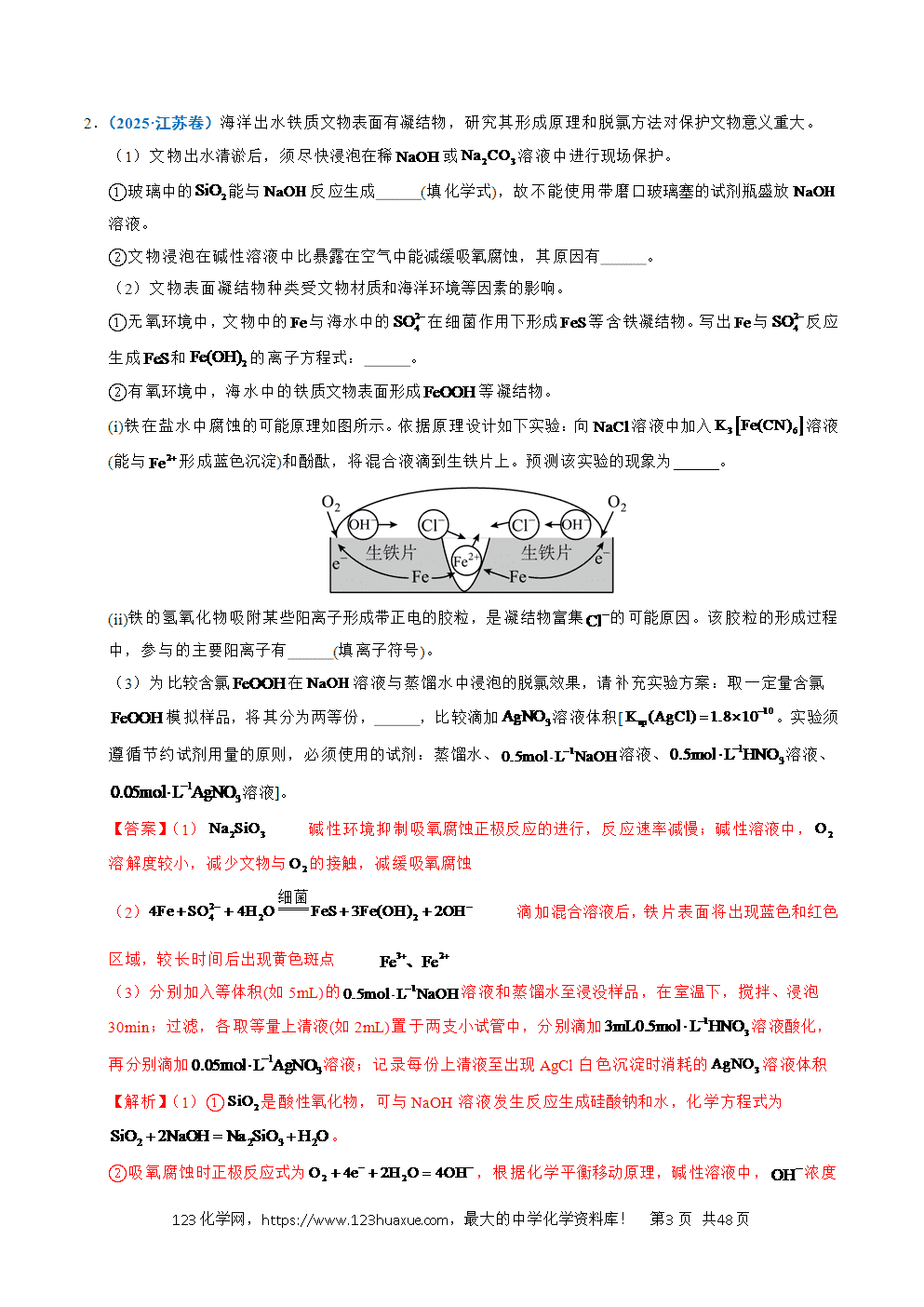
(i)铁在盐水中腐蚀的可能原理如图所示。依据原理设计如下实验:向溶液中加入溶液(能与形成蓝色沉淀)和酚酞,将混合液滴到生铁片上。预测该实验的现象为 。
(ii)铁的氢氧化物吸附某些阳离子形成带正电的胶粒,是凝结物富集的可能原因。该胶粒的形成过程中,参与的主要阳离子有 (填离子符号)。
(3)为比较含氯在溶液与蒸馏水中浸泡的脱氯效果,请补充实验方案:取一定量含氯模拟样品,将其分为两等份, ,比较滴加溶液体积[。实验须遵循节约试剂用量的原则,必须使用的试剂:蒸馏水、溶液、溶液、溶液]。
【答案】(1) 碱性环境抑制吸氧腐蚀正极反应的进行,反应速率减慢;碱性溶液中,溶解度较小,减少文物与的接触,减缓吸氧腐蚀
(2) 滴加混合溶液后,铁片表面将出现蓝色和红色区域,较长时间后出现黄色斑点
(3)分别加入等体积(如5mL)的溶液和蒸馏水至浸没样品,在室温下,搅拌、浸泡30min;过滤,各取等量上清液(如2mL)置于两支小试管中,分别滴加溶液酸化,再分别滴加溶液;记录每份上清液至出现AgCl白色沉淀时消耗的溶液体积
【解析】(1)①是酸性氧化物,可与NaOH溶液发生反应生成硅酸钠和水,化学方程式为。
②吸氧腐蚀时正极反应式为,根据化学平衡移动原理,碱性溶液中,浓度较大,会抑制得电子,使吸氧腐蚀的速率减慢;在高离子浓度的液体中溶解度较小,碱性溶液比纯水溶解氧的能力低,减少了文物与的接触,减缓吸氧腐蚀。
(2)①无氧、弱碱性的海水中,Fe在细菌作用下,被氧化为价的FeS、,根据得失电子守恒、电荷守恒、原子守恒可写出该反应的离子方程式:。
②(ⅰ)由题图知,铁片在NaCl溶液中发生吸氧腐蚀,开始时,负极反应式为,正极反应式为。与反应生成蓝色沉淀,即铁片上会出现蓝色区域;溶液中酚酞遇到变红,铁片上会出现红色区域;由“有氧环境中,海水中的铁质文物表面形成FeOOH”知,在盐水中被氧化成黄色的FeOOH,故现象是滴加混合溶液后,铁片表面将出现蓝色和红色区域,较长时间后出现黄色斑点;
(ⅱ)铁片发生吸氧腐蚀,负极区生成,被进一步氧化为,此时体系中的阳离子主要有。
(3)要检验脱氯效果,应控制样品用量、脱氯时间、取用体积等变量相同,利用与的反应进行实验。实验中,首先需要将等量的含氯FeOOH模拟样品分别用等体积的NaOH溶液与蒸馏水浸泡脱氯,然后过滤,得到上清液,取等体积的两种上清液,先用溶液酸化,再加入溶液,通过比较出现AgCl白色沉淀时消耗。溶液体积的大小,即可比较脱氯效果。