













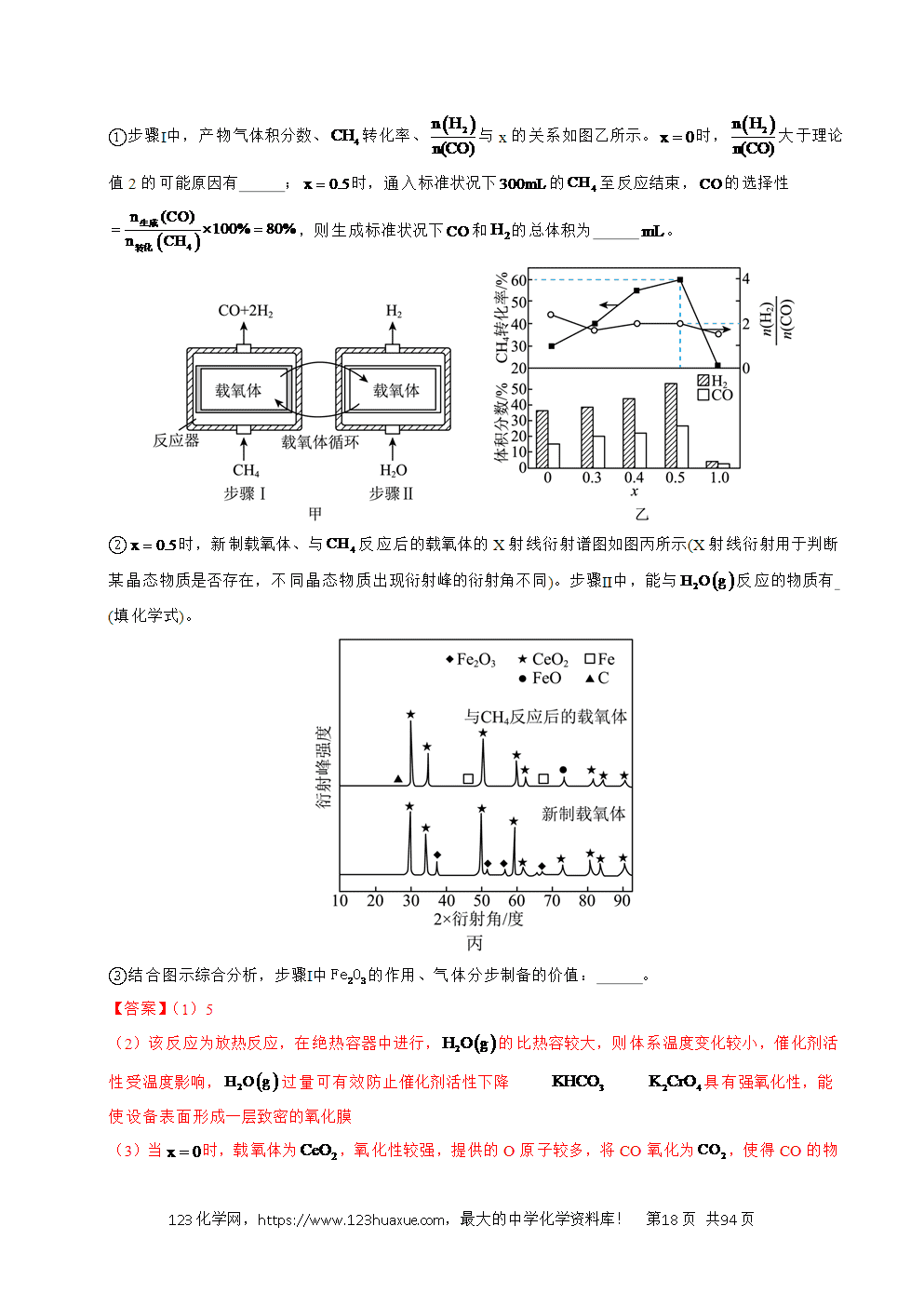


1.(2025·安徽卷)I.通过甲酸分解可获得超高纯度的。甲酸有两种可能的分解反应:
①
②
(1)反应的 。
(2)一定温度下,向恒容密闭容器中通入一定量的,发生上述两个分解反应下列说法中能表明反应达到平衡状态的是 (填标号)。
a.气体密度不变 b.气体总压强不变
c.的浓度不变 d.和的物质的量相等
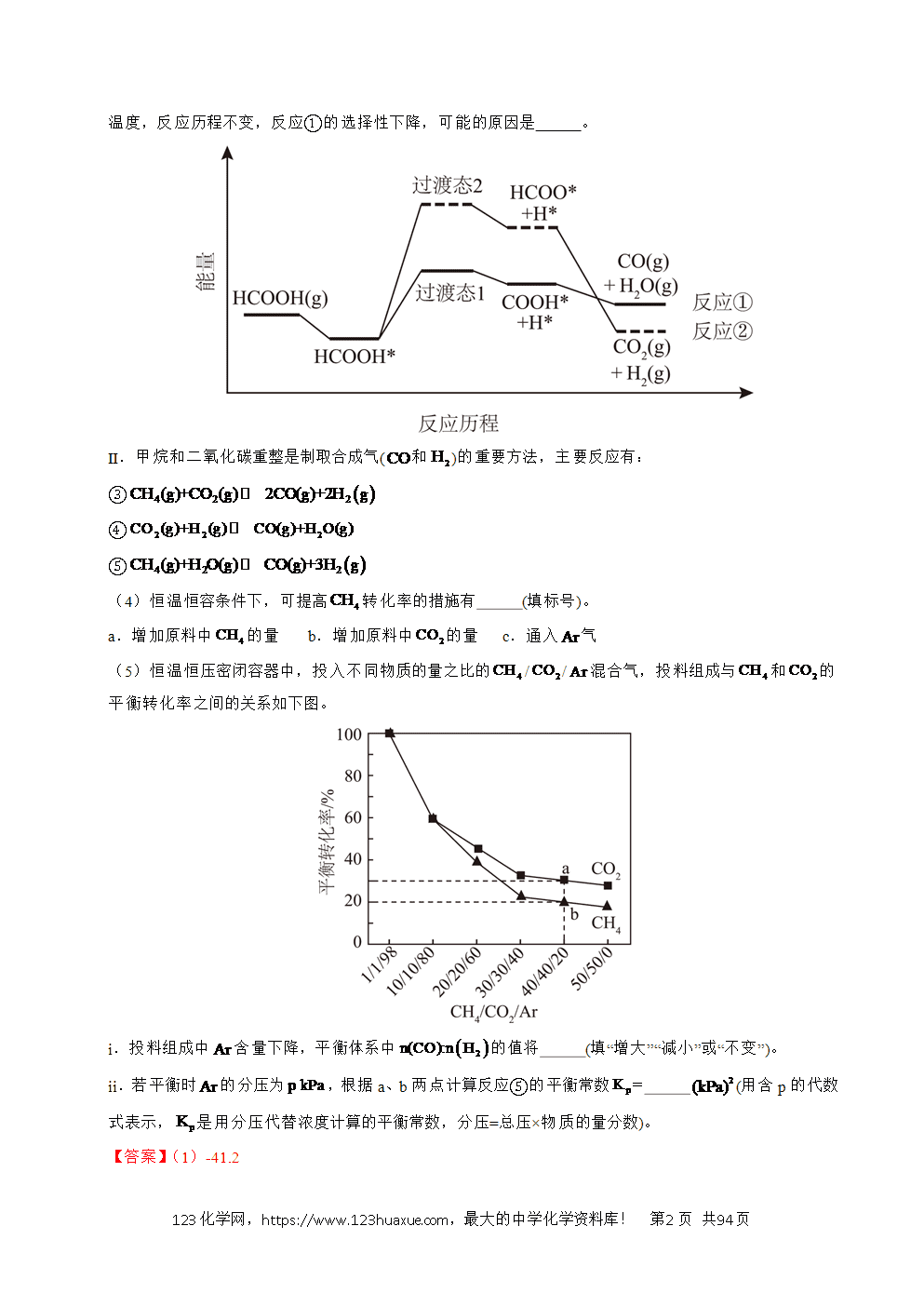
(3)一定温度下,使用某催化剂时反应历程如下图,反应①的选择性接近,原因是 ;升高温度,反应历程不变,反应①的选择性下降,可能的原因是 。
Ⅱ.甲烷和二氧化碳重整是制取合成气(和)的重要方法,主要反应有:
③
④
⑤
(4)恒温恒容条件下,可提高转化率的措施有 (填标号)。
a.增加原料中的量 b.增加原料中的量 c.通入气
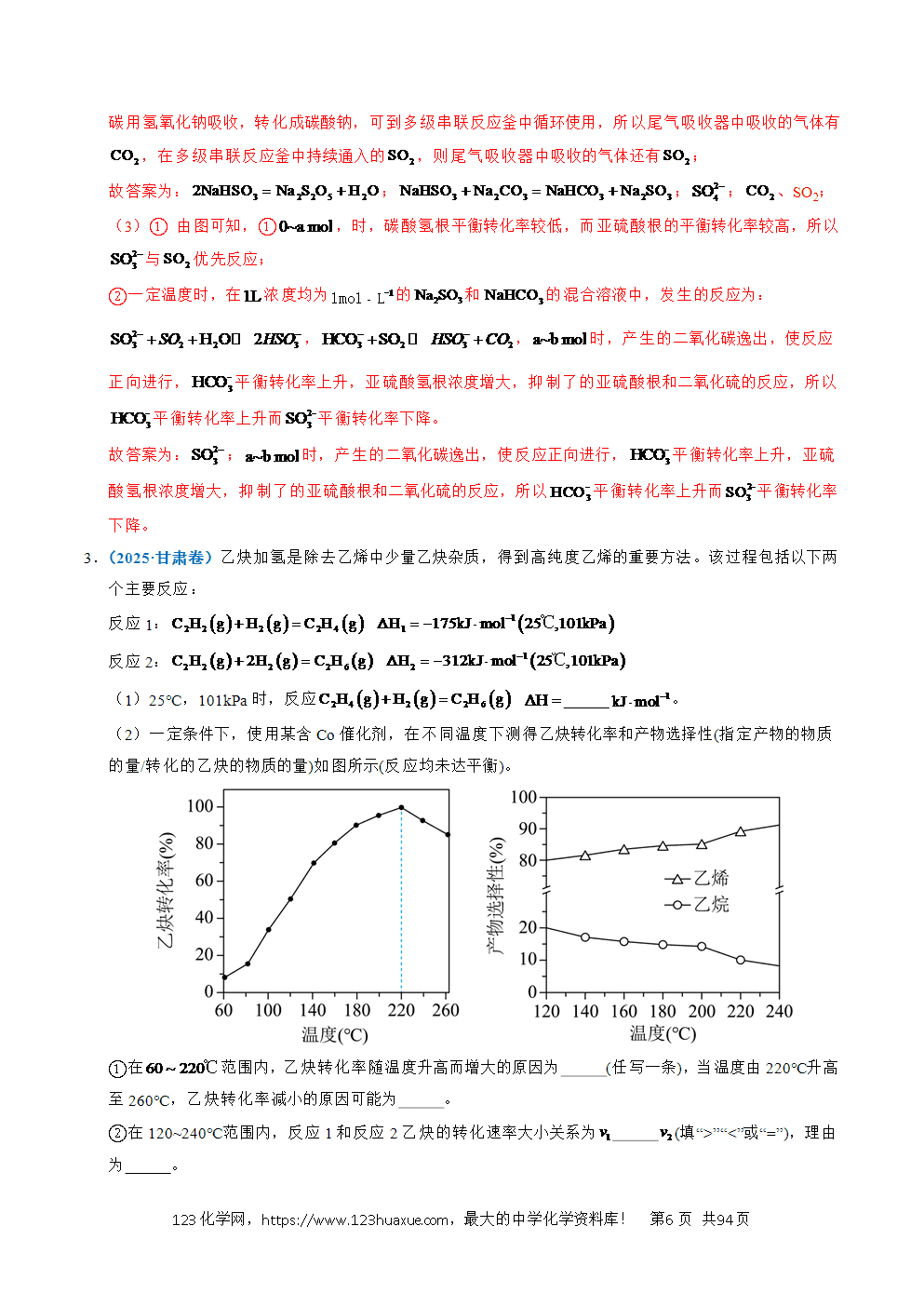
(5)恒温恒压密闭容器中,投入不同物质的量之比的//混合气,投料组成与和的平衡转化率之间的关系如下图。
i.投料组成中含量下降,平衡体系中的值将 (填“增大”“减小”或“不变”)。
ii.若平衡时的分压为,根据a、b两点计算反应⑤的平衡常数 (用含p的代数式表示,是用分压代替浓度计算的平衡常数,分压=总压×物质的量分数)。
【答案】(1)-41.2
(2)bc
(3)原因是反应①的活化能低,反应②活化能高,反应②进行的速率慢 催化剂在升温时活性降低或升温时催化剂对反应②更有利
(4)b
(5)增大 0.675p2
【解析】(1)由盖斯定律,②-①可以得到目标反应,则;
(2)a.气体质量是定值,体积是固定的,密度始终不变,气体密度不变,不能说明达到平衡状态;
b.两个反应均为气体体积增大的反应,则随着反应进行,压强变大,压强不变是平衡状态;
c.气体浓度不变是平衡状态的标志,则浓度不变,是平衡状态;
d.CO和CO2物质的量相等,不能说明其浓度不变,不能判断达到平衡状态;
故选bc;
(3)反应①的选择性接近100%,原因是反应①的活化能低,反应②活化能高,反应②进行的速率慢,所以反应①的选择性接近100%;反应①是吸热反应,升高温度平衡会正向移动,会有利于反应①,但反应①选择性下降,可能原因是催化剂在升温时活性降低或升温时催化剂对反应②更有利;
(4)a.增加原料中CH4的量,CH4自身转化率降低;
b.增大原料中CO2的量,CH4转化率增大;
c.通入Ar,各物质浓度不变,平衡不移动,CH4转化率不变;
故选b;
(5)如图可知,恒压时,随着Ar含量上升(图像从右到左),反应物的分压减小,相当于减压,平衡正向移动,压强不影响反应④平衡移动;则随着Ar含量下降,反应③和⑤平衡逆向移动,但甲烷的转化率下降的更快,而反应①甲烷二氧化碳转化率相同,说明反应⑤逆移程度稍小,但CO减小的少,则n(CO):n(H2)增大;
设初始投料:、、,平衡时,甲烷转化率为20%,二氧化碳的转化率为30%,则平衡时:
;
;
根据碳元素守恒:;
根据氧元素守恒:;
根据氢元素守恒:;
平衡时,气体总物质的量为,Ar的分压为,则总压为,、、