





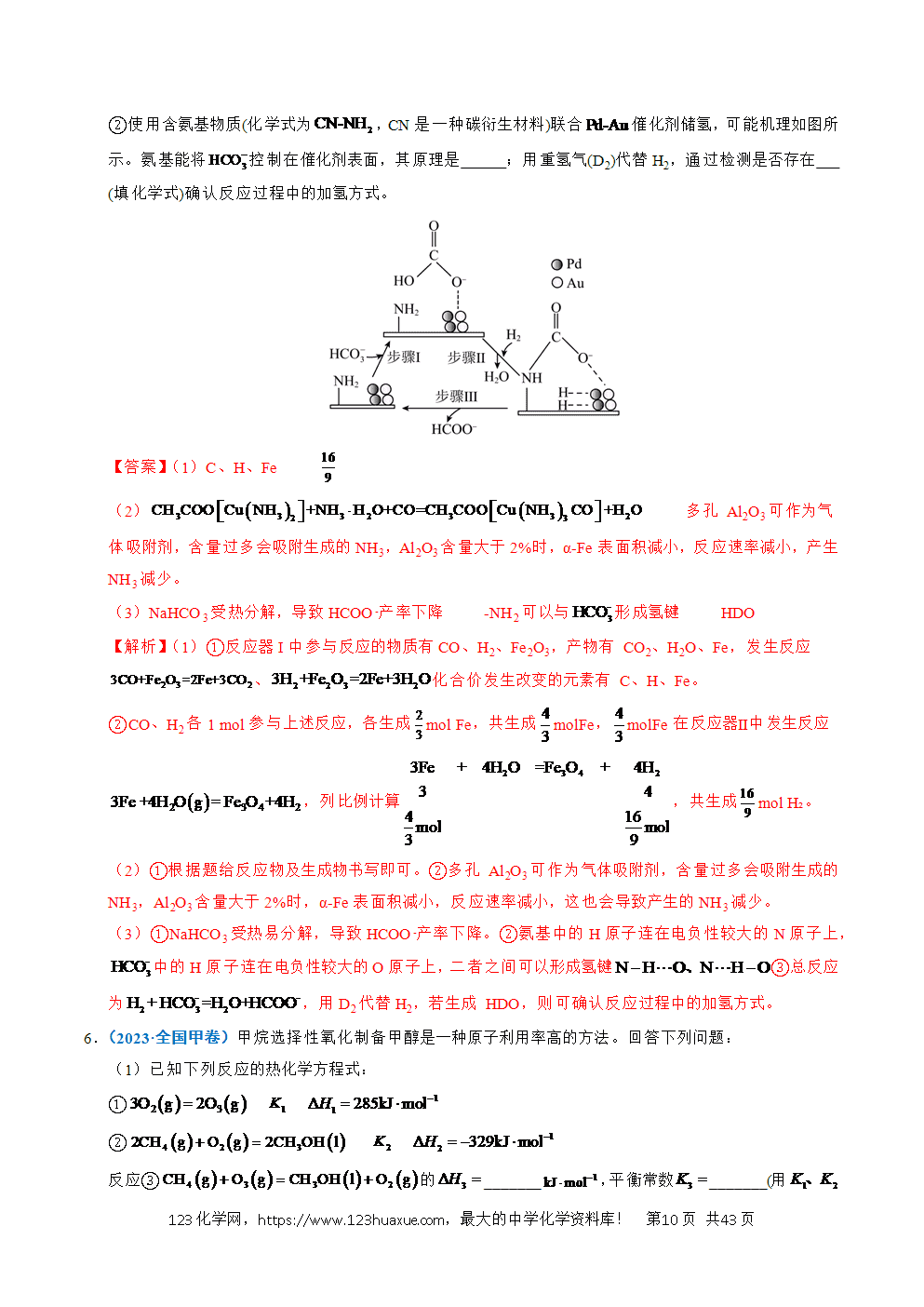
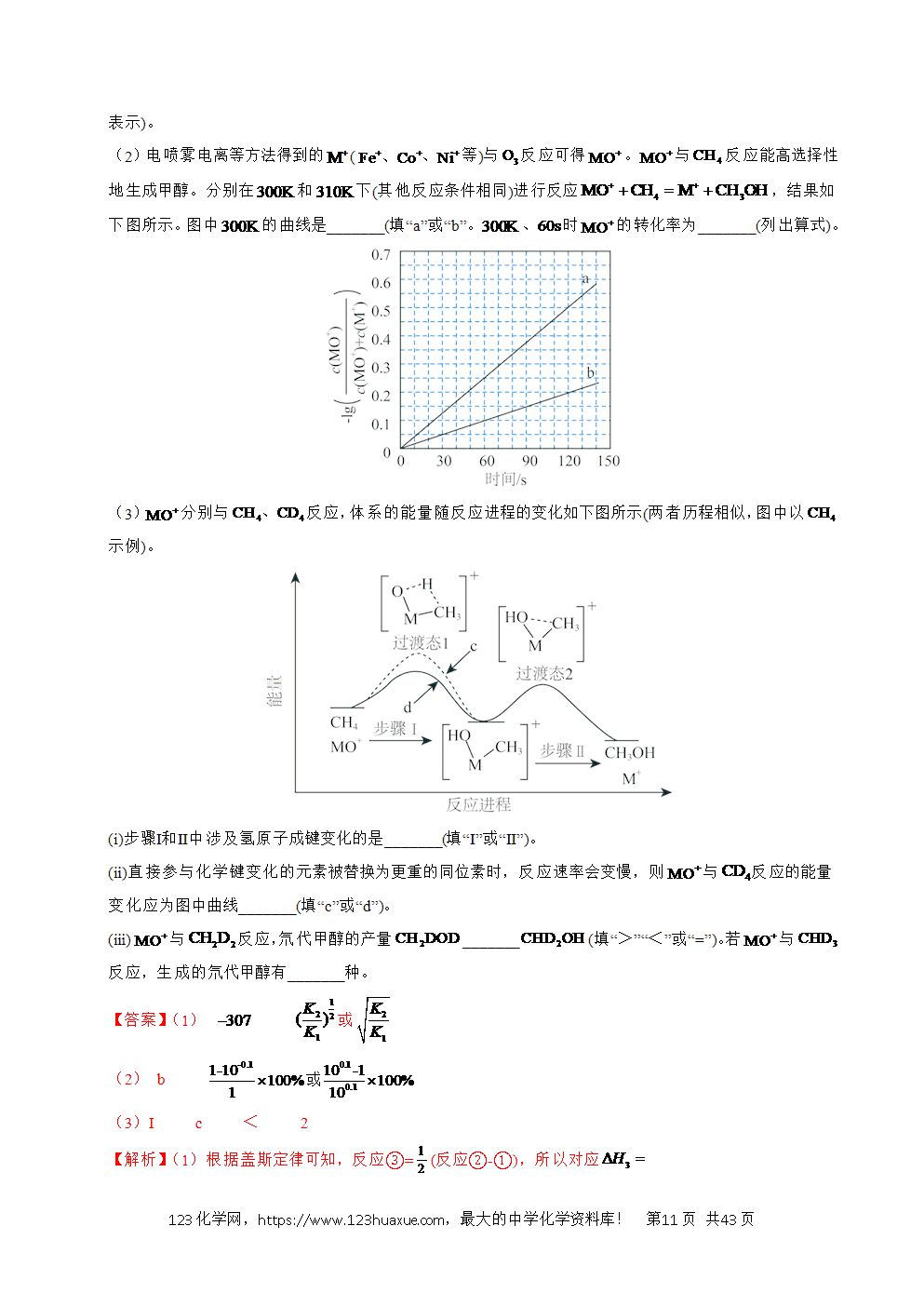


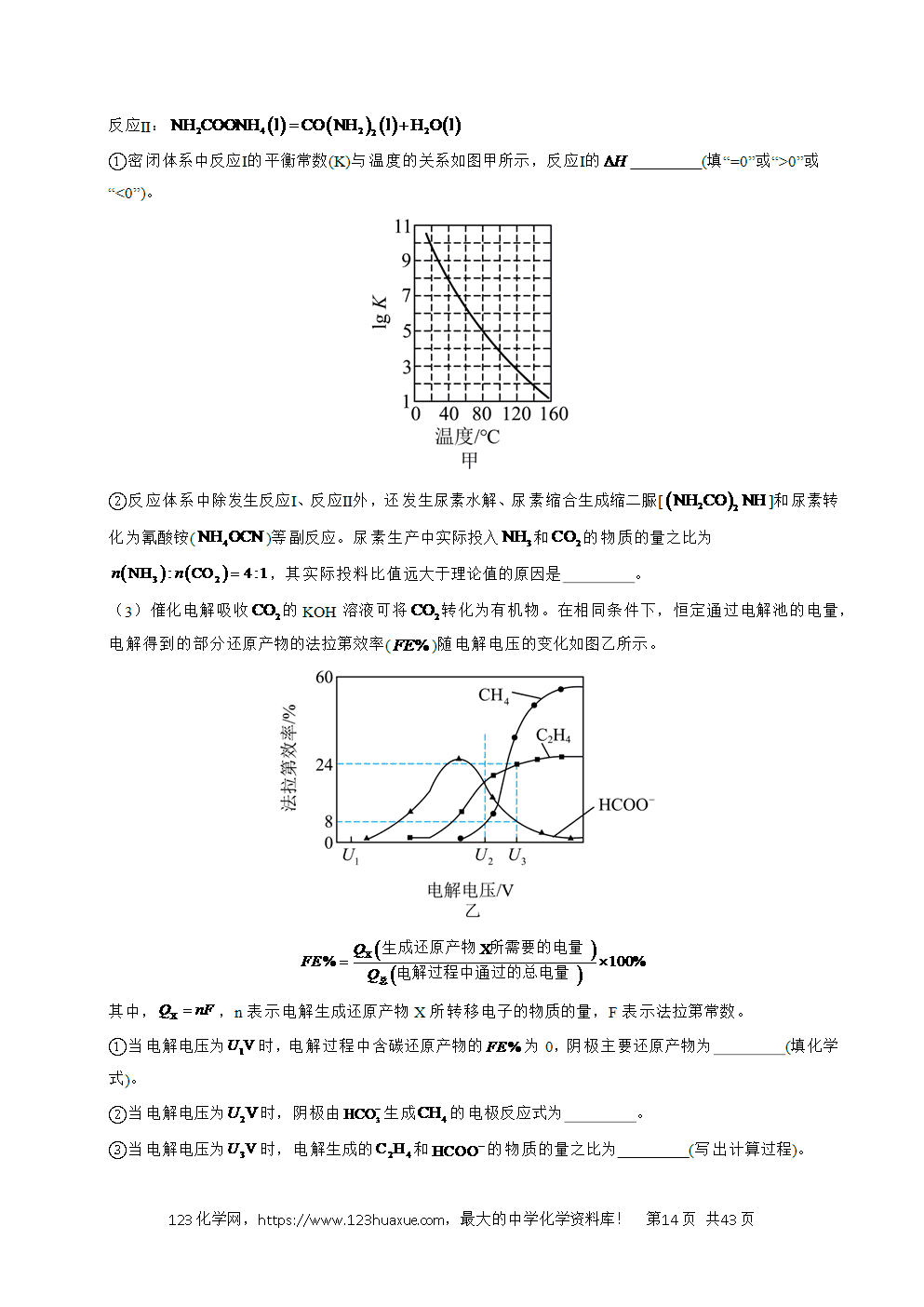

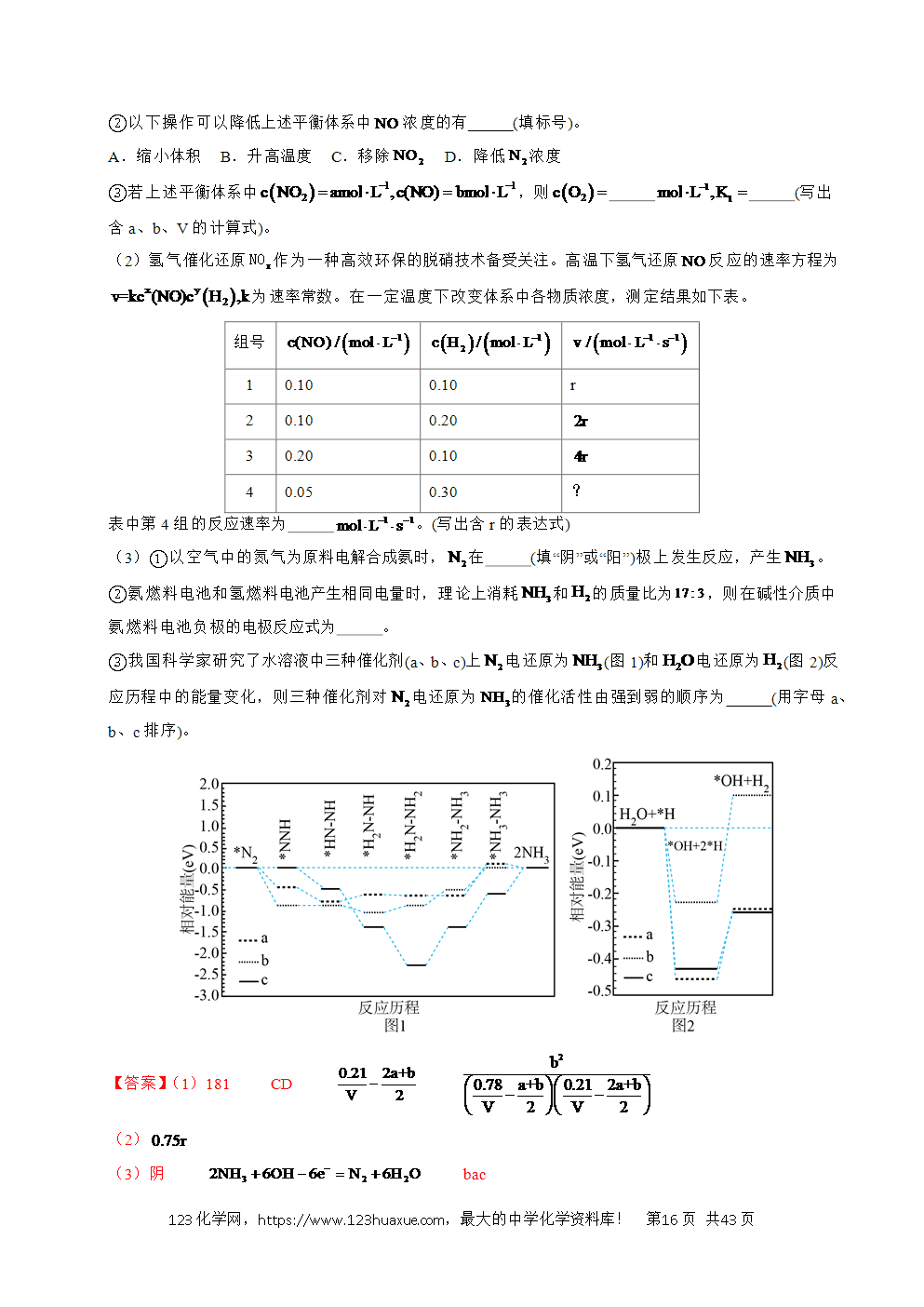





2.(2024·浙江6月卷)氢是清洁能源,硼氢化钠()是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为,)
请回答:
(1)该反应能自发进行的条件是_______。
A.高温 B.低温 C.任意温度 D.无法判断
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
A.升高溶液温度 B.加入少量异丙胺
C.加入少量固体硼酸 D.增大体系压强
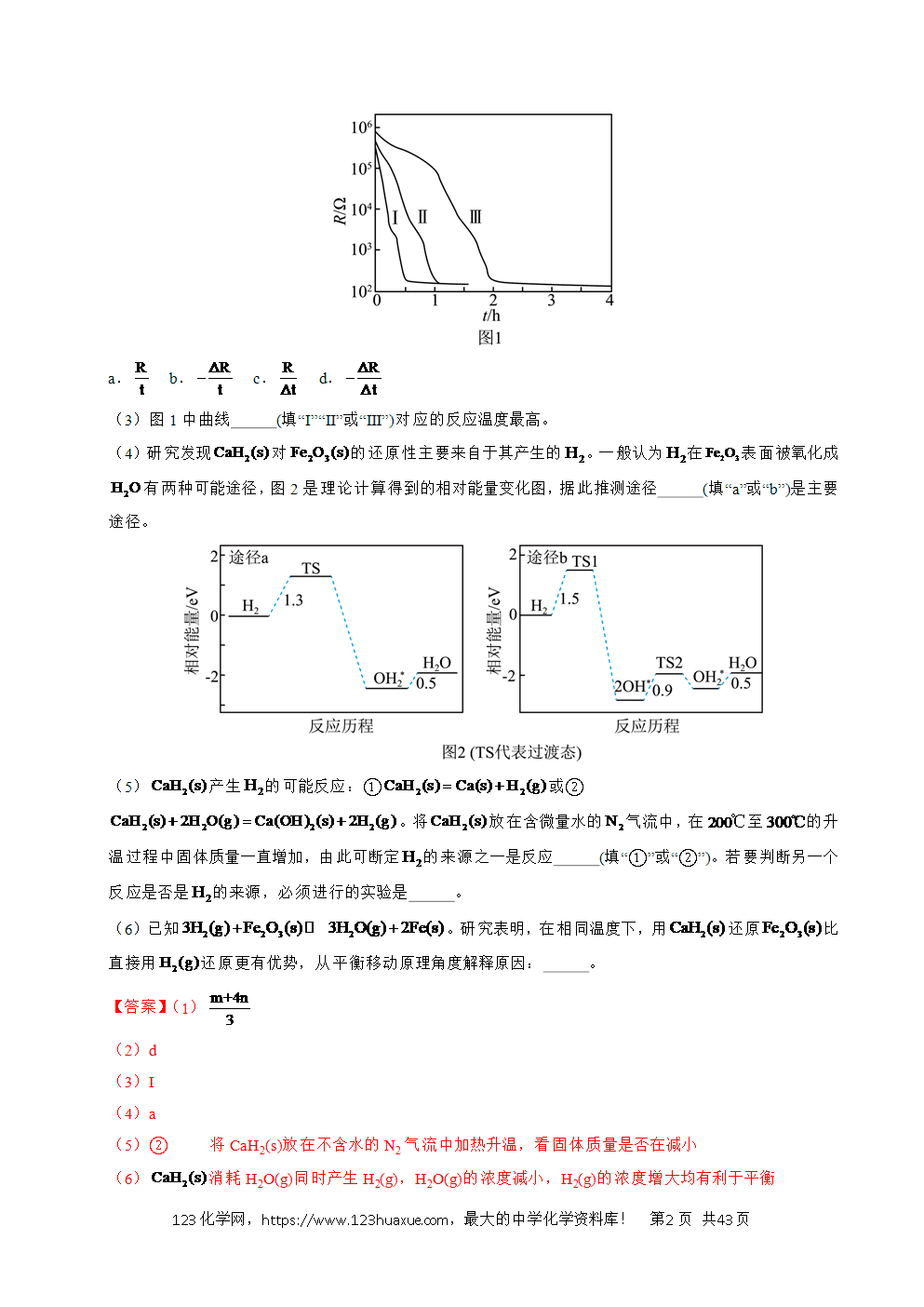
(3)为加速水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比之间的关系,结果如图1所示。请解释ab段变化的原因 。
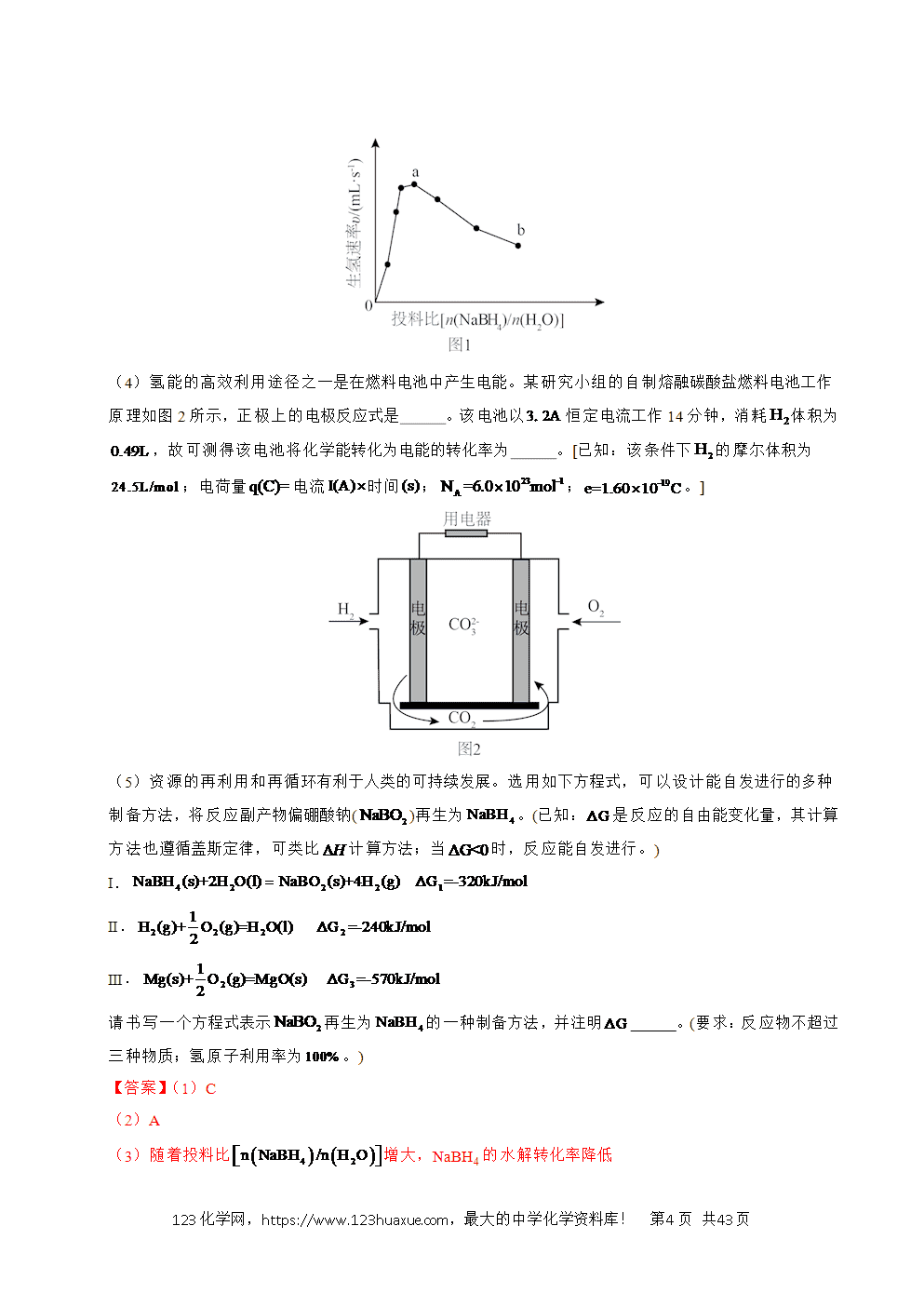
(4)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如图2所示,正极上的电极反应式是 。该电池以恒定电流工作14分钟,消耗体积为,故可测得该电池将化学能转化为电能的转化率为 。[已知:该条件下的摩尔体积为;电荷量电流时间;;。]
(5)资源的再利用和再循环有利于人类的可持续发展。选用如下方程式,可以设计能自发进行的多种制备方法,将反应副产物偏硼酸钠()再生为。(已知:是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比计算方法;当时,反应能自发进行。)
I.
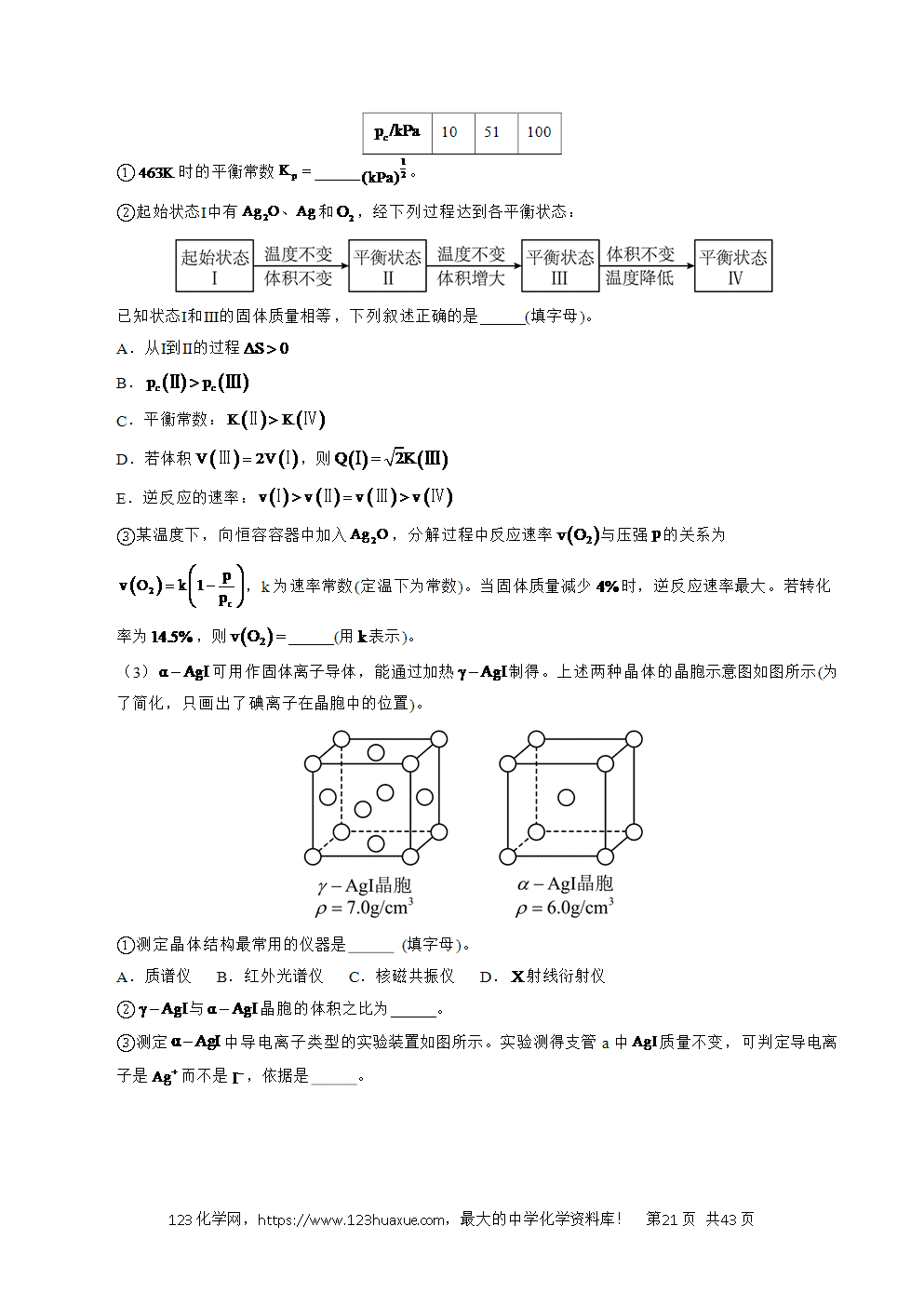
II.
III.
请书写一个方程式表示再生为的一种制备方法,并注明 。(要求:反应物不超过三种物质;氢原子利用率为。)
【答案】(1)C
(2)A
(3)随着投料比增大,NaBH4的水解转化率降低
(4)O2+4e-+2CO2=2 70%
(5)
【解析】(1)反应, ,由可知,任意温度下,该反应均能自发进行,故答案选C;
(2)A.升高温度,活化分子数增多,有效碰撞几率增大,反应速率加快,A符合题意;
B.加入少量异丙胺,H2O的量减少,化学反应速率降低,B不符合题意;
C. 加入少量固体硼酸,H2O的量减少,化学反应速率降低,C不符合题意;
D.增大体系压强,忽略体积变化,则气体浓度不变,化学反应速率不变,D不符合题意;
答案选A。
(3)随着投料比增大,NaBH4的水解转化率降低,因此生成氢气的速率不断减小。
(4)根据题干信息,该燃料电池中H2为负极,O2为正极,熔融碳酸盐为电解质溶液,故正极的电极反应式为:O2+4e-+2CO2=2, 该条件下,0.49L H2的物质的量为,工作时,H2失去电子:H2-2e-=2H+,所带电荷量为:2×0.02mol×6.0×1023mol-1×1.60×10-19= 3840C,工作电荷量为:3.2×14×60=2688C,则该电池将化学能转化为电能的转化率为:;
(5)结合题干信息,要使得氢原子利用率为100%,可由(2×反应3)-(2×反应Ⅱ+反应Ⅰ)得, 。