
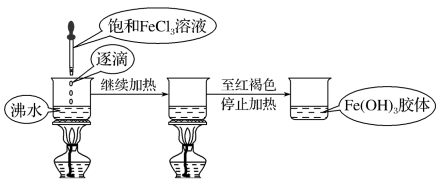
实验装置

实验原理:
①胶体可发生丁达尔效应,即当光束通过胶体时,会产生光亮的通路。
②氢氧化铁胶体制备:FeCl3+3H2O Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
实验用品:
蒸馏水、CuSO4溶液、泥水、水、FeCl3饱和溶液;酒精灯、铁架台、石棉网、烧杯、胶头滴管、激光笔(或手电筒)。
实验步骤:
①取两个100mL小烧杯,分别加入 40mL 蒸馏水和40mL CuSO4溶液。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入 5~6 滴 FeCl3饱和溶液。继续煮沸至液体呈红褐色,停止加热。观察制得的 Fe(OH)3胶体,并与CuSO4溶液比较。
②把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用红色激光笔照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。
实验现象:
①当光束通过CuSO4溶液时,无光路现象出现。当光束通过 Fe(OH)3胶体时,可以看到形成一条光亮的通路。
②将Fe(OH)3胶体过滤后溶液仍呈红褐色;
实验结论:
溶液没有丁达尔效应,胶体有丁达尔效应。

1.氢氧化铁胶体制备注意事项
(1)自来水含有电解质等,易使胶体聚沉,需用蒸馏水制备。
(2)FeCl3溶液要求是饱和的,是为了提高转化效率,若浓度过稀,不利于 Fe(OH)3胶体的形成。
(3)可稍微加热沸腾,但不宜长时间加热,否则胶体会聚沉。
(4)边滴加 FeCl3饱和溶液边振荡烧杯,但不能用玻璃棒搅拌,否则会使Fe(OH)3胶体微粒形成大颗粒沉淀析出。
2.书写Fe(OH)3胶体制备化学方程式的四个易错点
(1)用“=”而不用“ ”;
”;
(2)Fe(OH)3分子式后注明胶体而不使用“↓”符号;
(3)反应条件是“△”;
(4)HCl后不能标“↑”符号。
3.丁达尔效应是区分胶体与溶液的一种常用物理方法。