
1.制取原理
实验室通常用强氧化剂MnO2、KMnO4、K2Cr2O7、KClO3、Ca(ClO)2等氧化浓盐酸制取氯气。
(1)用MnO2制取Cl2的化学方程式:MnO2+4HCl(浓)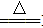 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)其他制备Cl2的化学反应原理(特点:不需要加热)
①14HCl(浓)+K2Cr2O7=2KCl+2CrCl3+7H2O+3Cl2↑
②16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑
③6HCl(浓)+KClO3=KCl+3H2O+3Cl2↑
④4HCl(浓)+Ca(ClO)2=CaCl2+2Cl2↑+2H2O
2.实验装置

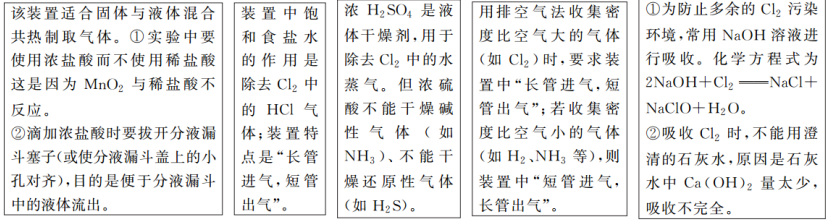
制取流程
(1)制备装置类型:固体+液体(→)气体
(2)净化方法:用饱和食盐水除去HCl,再用浓硫酸除去水蒸气。
(3)收集方法:①氯气的密度比空气大,可用向上排空气法收集②氯气在饱和食盐中的溶解度较小,可用排饱和食盐水法收集。
(4)验满方法:①将湿润的淀粉KI试纸靠近盛Cl2的试剂瓶口,观察到试纸立即变蓝,则证明已集满;②将湿润的蓝色石蕊试纸靠近盛Cl2的试剂瓶口,观察到试纸先变红后退色,则证明已集满;③根据氯气的颜色,装置充满了黄绿色气体,则证明已集满。
(5)尾气吸收:用强碱溶液(如NaOH溶液)吸收。