目 录
《第五章 化工生产中的重要非金属元素》回看索引
《第五章 化工生产中的重要非金属元素》重点知识总结
《第六章 化学反应与能量》回看索引
《第六章 化学反应与能量》重点知识总结
《第七章 有机化合物》回看索引
《第七章 有机化合物》重点知识总结
《第八章 化学与可持续发展》回看索引
《第八章 化学与可持续发展》重点知识总结
《必修第二册》回看测试
《第五章 化工生产中的重要非金属元素》回看索引
P2:硫有多种同素异形体。游离态的硫存在于火山喷口附近或地壳的岩层里。硫俗称硫黄,是一种黄色晶体,硫难溶于水,微溶于酒精,易溶于二硫化碳。试管内壁的硫可以用热碱洗涤(3S+6NaOH2Na2S+Na2SO3+3H2O)。
P2:1体积的水可以溶解约40体积的二氧化硫
P3:【实验5-1】SO2溶于水时可与水反应生成亚硫酸 可逆反应
P3:SO3溶于水时发生剧烈反应生成硫酸
P3:SO2 + 2H2S = 3S + 2H2O
P3:【实验5-2】二氧化硫的漂白性 SO2能使品红褪色,加热又恢复原来的颜色,这是由于它能与某些(遇紫色石蕊溶液只变红)有些物质化合生成不稳定的无色物质,该不稳定的无色物质会慢慢分解,受热则很快分解恢复原来的颜色。SO2的漂白是化合作用,属于暂时性漂白,Na2O2、HClO的漂白为强氧化性,为永久性漂白,不能恢复原来的颜色。SO2还能杀菌消毒,SO2和某些含硫化合物的漂白作用也被一些不法厂商非法用来加工食品,以使食物增白,食用这类食品对人体的肝、肾等有严重的损害,并有致癌作用。空气中SO2的主要来源是大量燃烧煤、石油等化石燃料,其次是来自火山爆发和金属冶炼厂、硫酸厂等的工业废气。
P4:资料卡片——食品中的二氧化硫 二氧化硫可用于杀菌消毒,还是一种食品添加剂
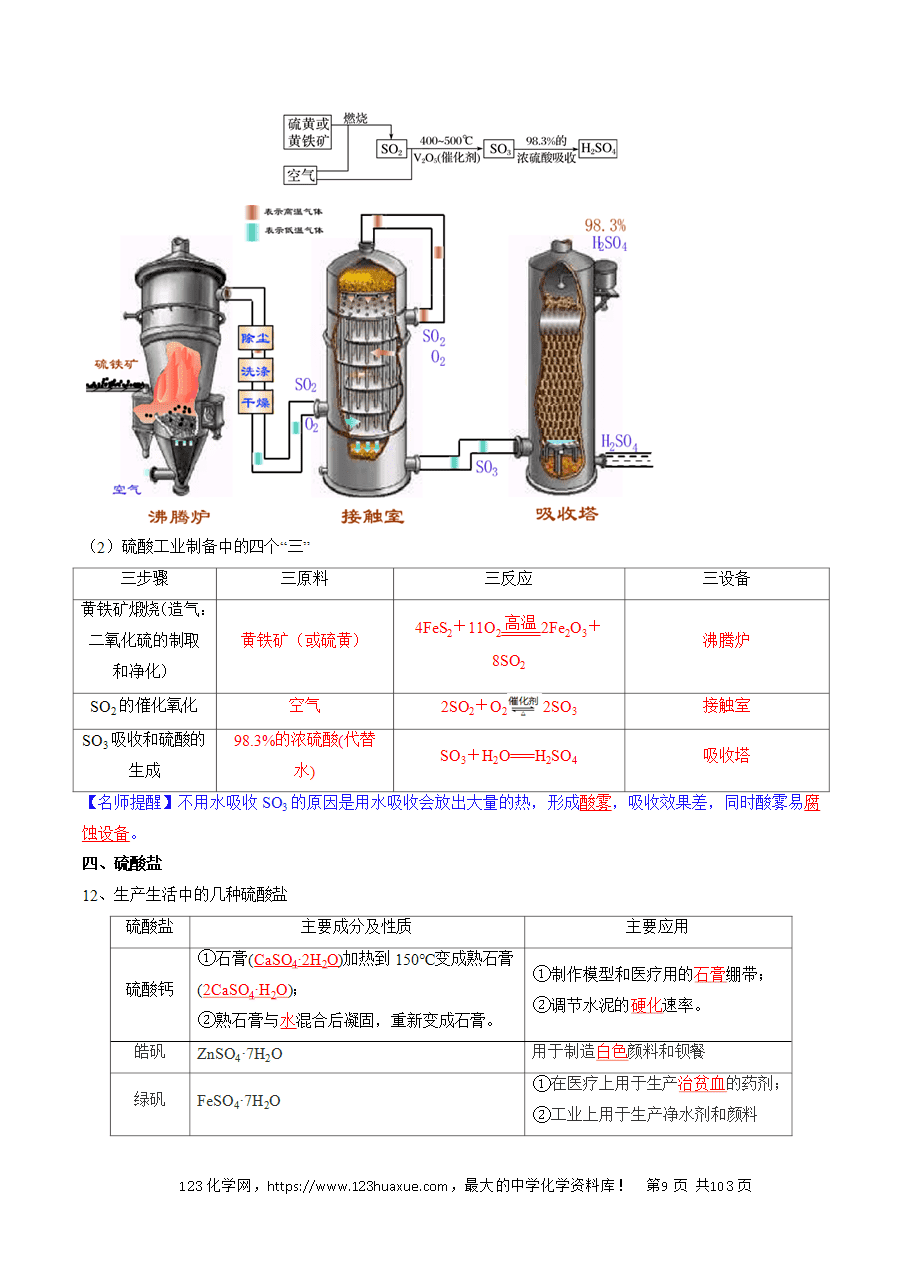
P4:图5-4 工业制硫酸的原理示意图
P4:图5-5 浓硫酸与蔗糖反应 浓硫酸具有吸水性、脱水性、强氧化性三大特性。吸水性常用作干燥剂,不能干燥NH3[不是因为强氧化性。2NH3+H2SO4=(NH4)2SO4]和还原性气体如H2S、HBr、HI。但可以干燥SO2。脱水性属于化学变化。P101图4-31黑面包实验的具体操作为在烧杯中放入适量蔗糖,用少量水调成糊状,注入浓硫酸,用玻棒搅拌。蔗糖变黑,体积膨胀,放出大量热,放出有刺激性气味的气体。黑面包实验体现了浓硫酸的脱水性和氧化性。有关反应为:C12H22O11=12C+11H2O;2H2SO4(浓)+CCO2↑+2H2O+2SO2↑。右图是C与浓H2SO4反应产物的鉴别。装置A中观察到的现象是白色粉末逐渐变蓝,装置B的作用是检验SO2,C的作用是除SO2,D的作用是检验SO2是否除尽,装置E中的试剂为澄清石灰水,用于检验CO2。强氧化性:在温下,浓硫酸能使铁、铝钝化。加热时浓硫酸能与大多数金属反应,但不生成氢气。
P5:【实验5-3】加热条件下,铜与浓硫酸反应 铜在加热时与浓硫酸反应,其化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。若铜过量,硫酸不能反应完,与MnO2与浓盐酸类似。与硫化氢、溴化氢、FeS等还原剂反应:H2S+H2SO4(浓)=S+SO2↑+2H2O、2HBr+H2SO4(浓)Br2+SO2↑+2H2O,2FeS+6H2SO4(浓)=Fe2(SO4)3+2S↓+3SO2↑+6H2O。图5-6 终止反应的操作是:向上拉铜丝。加热生成的气体通入品红溶液褪色。通入石蕊溶液生成H2SO3也只变红不褪色。硫酸工业所涉及的反应:4FeS2+11O2Fe3O4+8SO2、2SO2+O22SO3、SO3+H2O=H2SO4。
P6:资料卡片——硫酸盐:硫酸钙、硫酸钡、硫酸铜
P6:【实验5-4】硫酸根离子的检验
P6:思考与讨论——粗盐中除去可溶性硫酸盐及MgCl2、CaCl2等杂质的方法 除去粗盐中的Ca2+、Mg2+、SO42-等杂质,先加入过量的BaCl2,至沉淀不再产生后,再加入过量的Na2CO3、NaOH,充分反应后将沉淀一并滤去,经检测发现滤液中仍含有一定量的SO42-,其原因是BaSO4和BaCO3的Ksp差不大,当溶液中存在大量的CO32-时,BaSO4就会部分转化为BaCO3。其中Na2CO3的作用是:除Ca2+和过量的Ba2+。所以试剂加入顺序Na2CO3在之BaCl2后。
P7:资料卡片——自然界中硫的存在和转化
P11:氮的固定、自然固氮 氮的固定是指将游离态的氮转变为氮的化合物叫做氮的固定。
P12:人工固氮
P12:图5-9 自然界中氮的循环
P12:科学史话——合成氨