目 录
《第一章 化学反应的热效应》回看索引
《第一章 化学反应的热效应》重点知识总结
《第二章 化学反应速率与化学平衡》回看索引
《第二章 化学反应速率与化学平衡》重点知识总结
《第三章 水溶液中的离子反应与平衡》回看索引
《第三章 水溶液中的离子反应与平衡》重点知识总结
《第四章 化学反应与电能》回看索引
《第四章 化学反应与电能》重点知识总结
《选择性必修1》回看测试
《第一章 化学反应的热效应》回看索引
P4:体系、环境
P4:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热
P5:探究 中和反应反应热的测定 中和反应反应热的测定。该实验中,为了达到保温、隔热、减少实验过程中的热量损失,采取了哪些措施?每一次实验一共要测量几次温度?测定混合溶液的温度时是测量最高温度。除大小两个烧杯外,还有有两种重要的玻璃仪器名称是什么?注意观察它们的位置。50mL 0.5 mol/L盐酸温度为t1℃,50mL 0.55mol/L NaOH溶液温度为t2℃,混合溶液最高温度为t3℃,写出生成1 mol H2O的反应热的表达式(注意单位)。为了使盐酸充分中和,采用0.55mol/L NaOH的溶液,使碱过量。
P6:内能是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。
P6:焓:一个与内能有关的物理量。在等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变。
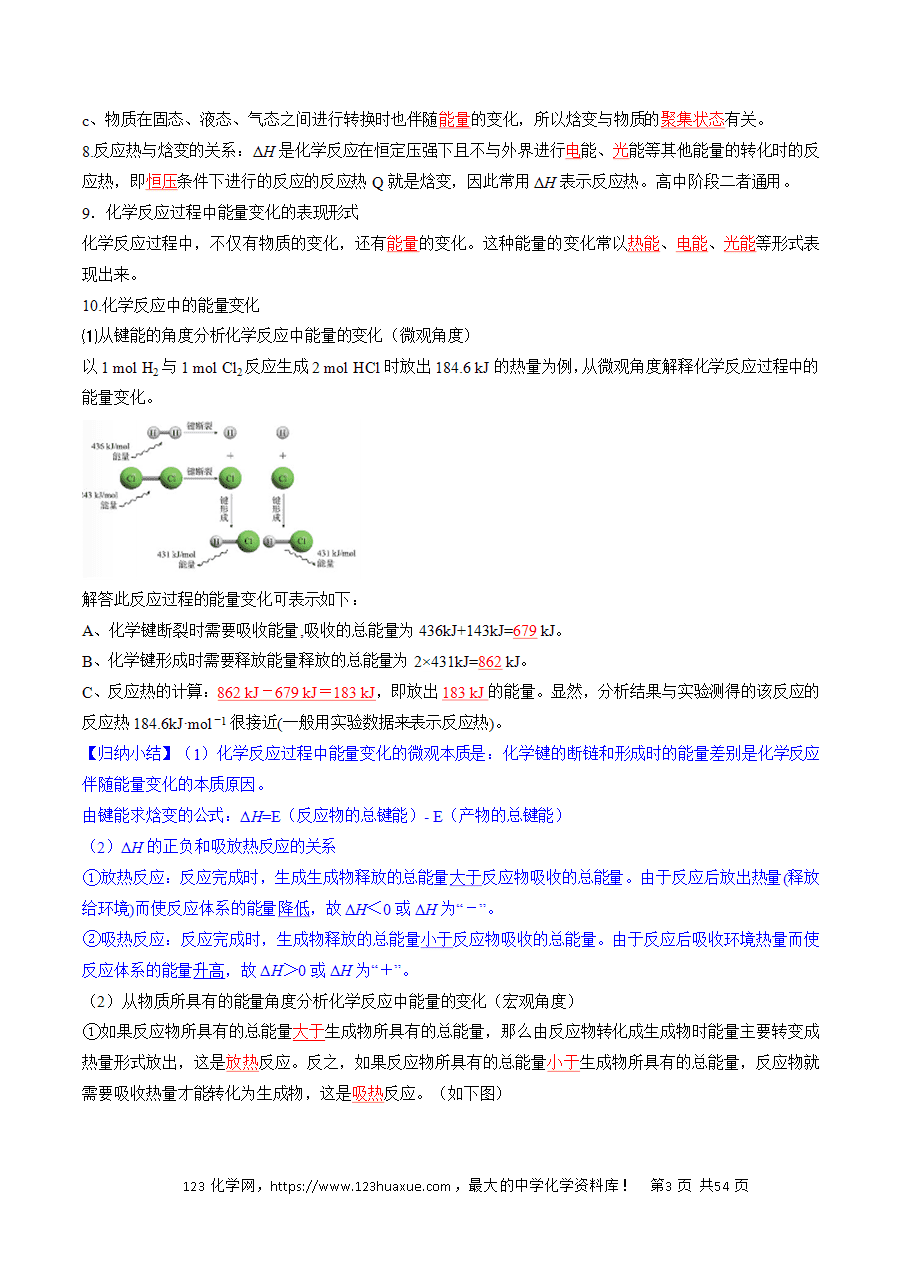
P7:化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
P8:热化学方程式 利用盖斯定律书写热化学方程式;表示燃烧热的热化学方程式(生成最稳定的氧化物,生成液态水);表示中和热的热化学方程式(除有H+、OH-外,如弱酸、浓硫酸、弱碱或生成沉淀的反应热与中和热的对比)。可逆反应的热化学方程式的意义。如299 K时,合成氨反应 N2 (g ) + 3H2 ( g )=2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量一定小于92.0 kJ。
P10:资料卡片——△H的单位中“mol-1”的含义。
P10:燃烧热:在101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,稳定氧化物C→CO2(g),H→H2O(l),S→SO2(g),N→N2(g),X→HX(g)。
P11:科学·技术·社会 重要的体内能源——脂肪
P12:火箭推进剂 ①液氢+液氧(燃烧效率高,昂贵,不易储存)。②肼—50:液态NO2+肼(燃烧效率一般,较易储存,相对便宜,腐蚀性极强)。③液氧+煤油(燃烧效率一般,价格适中,不易储存)
P14:盖斯定律
P16:科学史话 热化学研究的先驱——盖斯
《第一章 化学反应的热效应》重点知识总结
1.体系是与周围其他部分区分开来的根据需要所研究的对象。如将试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)。
2.环境是与体系相互影响的其他部分。如盛有溶液的试管和溶液之外的空气等看作环境。
3.反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
4.热量:指因温度不同而在体系与环境之间交换或传递的能量,可以是吸收能量也可以是放出能量。
强。
5.中和热
(1)概念:在稀溶液里,酸与碱发生中和反应生成1 mol水时所放出的热量。
(2)单位:kJ·mol-1或kJ/mol
(3)意义:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。它表示25℃、101kPa时,稀的强酸与稀的强碱反应生成生成水的量为1 mol水时的反应热就是中和热。
6.内能
①内能是体系内物质的各种能量的总和。
②符号:U
③影响因素:温度、压强和物质的聚集状态。
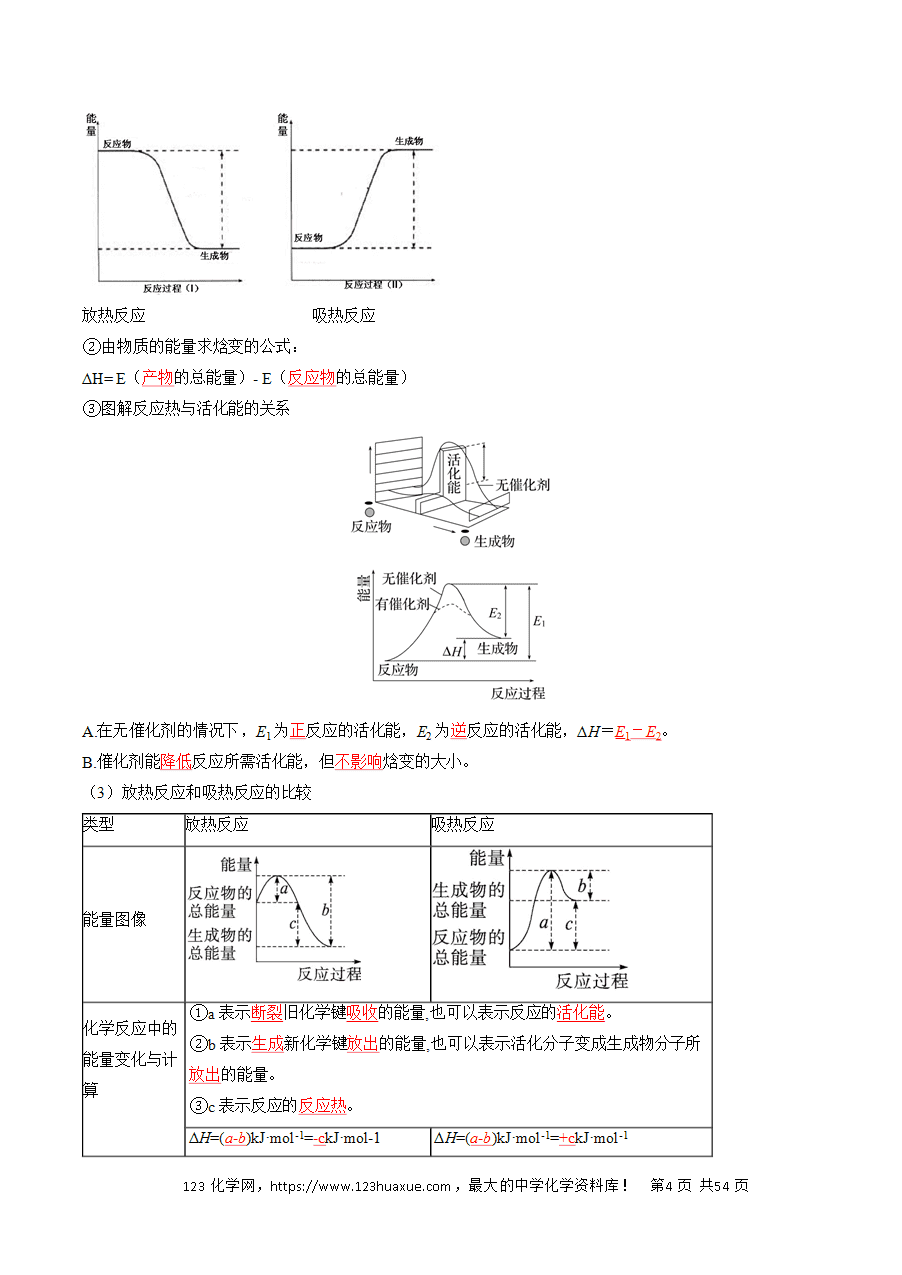
7.焓及焓变
①焓的意义:焓是一个物理量,用来表示物质所具有的能量,符号为H,用焓的变化来描述与反应热有关的能量变化。
②焓变:表示反应产物的总焓与反应物的总焓之差,符号用ΔH表示。
a、数学表达式:ΔH =H(反应产物)-H(反应物)
b、单位:kJ/mol或(kJ·mol-1)
c、意义:在一定条件下,可以通过焓变(ΔH)来确定一个反应是吸热反应还是放热反应。