目 录
《第一章 原子结构与性质》回看索引
《第一章 原子结构与性质》重点知识总结
《第二章 分子结构与性质》回看索引
《第二章 分子结构与性质》重点知识总结
《第三章 晶体结构与性质》回看索引
《第三章 晶体结构与性质》重点知识总结
《选择性必修1》回看测试
《第一章 原子结构与性质》回看索引
P2:氟、氯、溴、碘性质相似,因都成盐而总称为卤素;锂、钠、钾、铷、铯性质相似,因氢氧化物都是强碱而总称碱金属
P6:能层符号:K、L、M、N、O、P、Q
P6:能级符号:1s、2s、2p、3s、3p、3d、4s、4p、4d、4f 每一个能层分为不同的能级,能级符号用s、p、d、f表示,分别对应1、3、5、7个轨道。能级数=能层序数。
P8:原子光谱:发射光谱、吸收光谱 基态与激发态。焰色反应是原子核外电子从激发态回到基态释放能量。能量以焰色的形式释放出来。
P8:图1-4 Li、He、Hg发射光谱和吸收光谱
P8:图1-5构造原理(电子填入能级的顺序)示意图
P10:书写电子排布式时,一般情况下,能层低的能级要写在左边,而不是按照构造原理顺序写
P10:能级交错 构造原理是一个思维模型,是个假想过程,是被理想化了的
P11:价电子层,简称价层
P11:科学史话——离散的谱线 原子光谱为什么是离散的谱线而不是连续的呢?
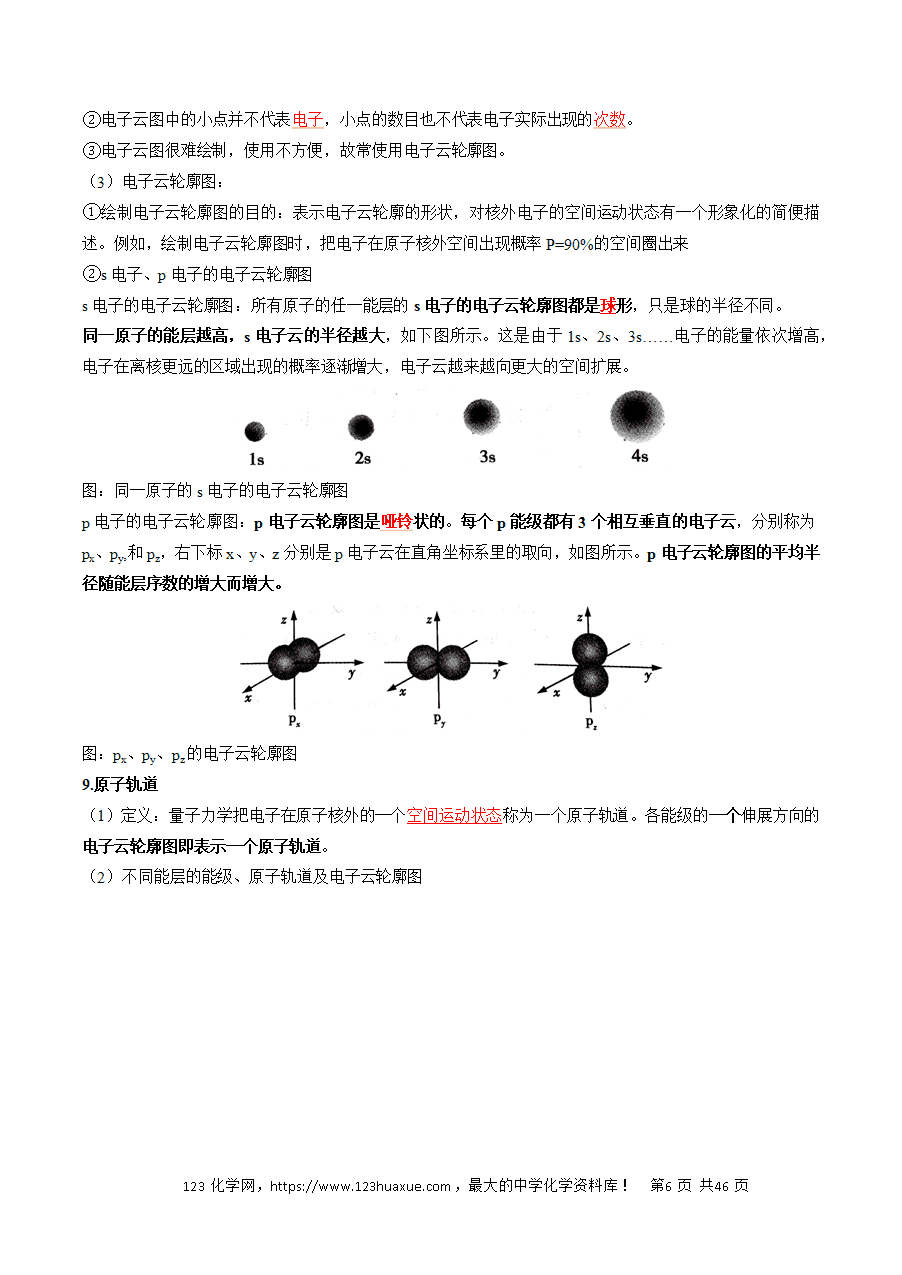
P12:概率密度、电子云、电子云轮廓图 不同能层相同能级的电子层形状相同。ns呈球形,np呈哑铃形。
P13:原子轨道、空间运动状态 常用电子云轮廓图的形状和取向表示原子轨道的形状和取向
P14:泡利原理:在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反
P15:资料卡片——电子自旋
P15:轨道表示式(又称电子排布图)
P15:洪特规则:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行
P16:能量最低原理:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低
P16:整个原子的能力由核电荷数、电子数和电子状态三个因素共同决定
P18:元素周期律、元素周期系、元素周期表 元素周期表的结构。周期(一、二、三短周期,四、五、六长周期,七不完全周期)和族(主族、副族、Ⅷ族、0零族)。分区(s、p、d、ds、f)。
P21:图1-19 元素周期表分区的简图
P22:图1-20 体现对角线规则的相关元素 在元素周期表中,某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”。Li、Mg在空气中燃烧的产物为LiO、MgO,铍与铝的氢氧化物Be(OH)2、Al(OH)3都是两性氢氧化物,硼与硅的最高价氧化物对应水化物的化学式分别为HBO2、H2SiO3都是弱酸。是因为这些元素的电负性相近。
P22:原子半径大小取决于两个相反的因素:电子的能层数、核电荷数
P23:电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量
P23:元素的第一电离能的周期性
P24:资料卡片——为什么B、Al、O、S等元素的电离能比它们左边元素的电离能低
P24:键合电子:原子中用于形成化学键的电子
P24:电负性:描述不同元素的原子对键合电子吸引力的大小
P25:鲍林利用实验数据进行了理论计算,以氟的电负性为4.0和锂的电负性为1.0作为相对标准,电负性的大小可以作为判断金属性和非金属性强弱的依据,金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8
P28:T5
P29:T7、T11
P31:T5、T8
P32:T11
《第一章 原子结构与性质》重点知识总结
1.原子结构模型的演变
(1)1869年,俄国化学家门捷列夫发现了元素周期表
(2)19世纪初,道尔顿提出了近代原子学说
(3)1913年,丹麦科学家玻尔提出了氢原子模型
(4)1920年,丹麦科学家波尔提出了构造原理
(5)1925年,丹麦科学家波尔的“壳层”落实为“能层”与“能级”厘清了核外电子的可能状态
(6)1936年,德国科学家马德隆发表了以原子光谱事实为依据的完整的构造理论
2.能层(相当于必修中的电子层)
(1)定义:核外电子按能量不同分成能层。
(2)电子的能层由内向外排序,其序号、符号以及所能容纳的最多电子数及能层的能量与能层离原子核距