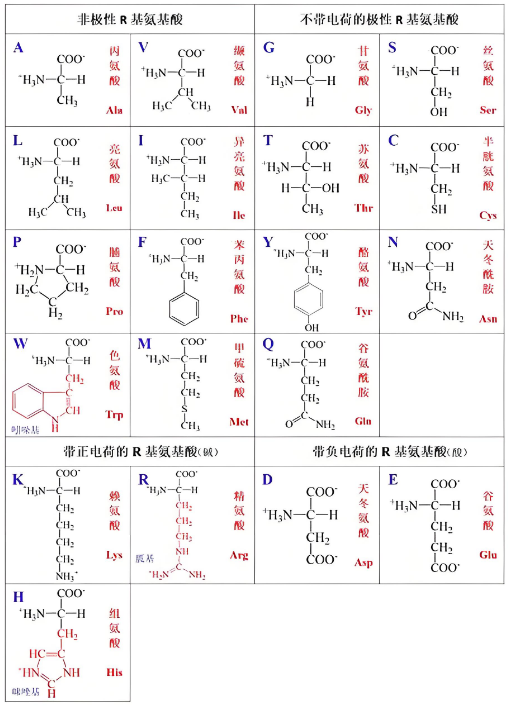
【导读】氨基酸难溶于乙醇、乙醚有机溶剂的本质原因是极性差异,氨基酸的两性离子结构的强极性与乙醇弱溶剂化能力的矛盾。简言之,乙醇的弱极性不足以破坏氨基酸强极性结构分子间的相互作用。
乙醇极性不足:介电常数低,无法有效屏蔽离子电荷或提供足够的氢键作用,导致溶剂化能力弱。
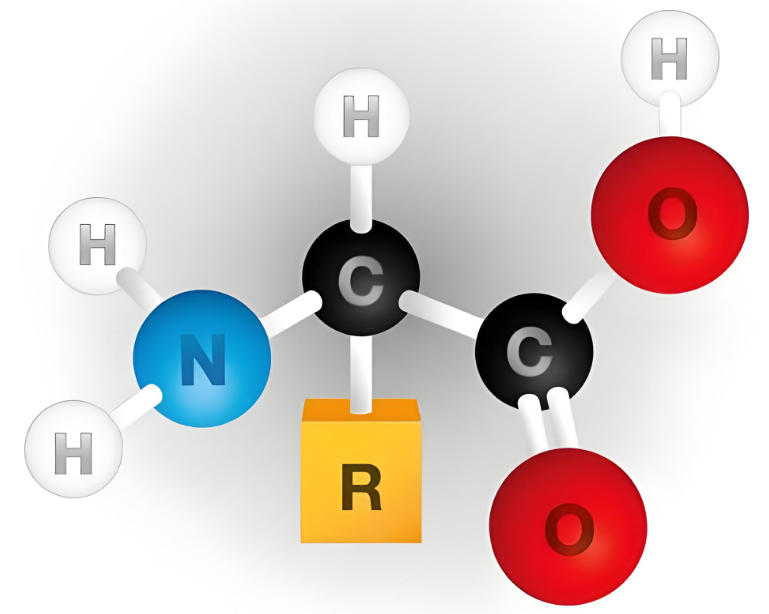
一、氨基酸的极性结构与“内盐”特性
氨基酸分子同时含有极性的氨基(-NH₂)和羧基(-COOH)。在固态或水溶液中,氨基易结合质子形成带正电的-NH₃⁺,羧基易解离出质子形成带负电的-COO⁻,从而以两性离子(内盐)的形式存在,如H₃N⁺-CHR-COO⁻。这种结构使氨基酸分子内部存在强烈的离子键相互作用(正负电荷相互吸引),分子极性极强,接近无机盐(如NaCl),晶格能较高,需强极性溶剂破坏。
水是强极性溶剂,介电常数78.5,溶剂化作用很强(极性分子包围离子,降低电荷相互作用),同时形成氢键作用溶解氨基酸,这些作用能够有效稳定氨基酸这种两性离子的带电结构,因此氨基酸易溶于水。
乙醇(C₂H₅OH)虽含极性羟基(-OH),但分子主体为非极性的碳链,整体极性较弱,介电常数仅约25,远低于水的介电常数,无法有效破坏氨基酸的离子键。
乙醚的介电常数4.3,弱极性,分子间以范德华力为主,几乎无法溶剂化离子。

二、“相似相溶”原理的影响
类比NaCl难溶于汽油,氨基酸的两性离子强极性结构与弱极性溶剂“极性不相似”,遵循“相似相溶”原理。
氨基酸以强极性的两性离子形式存在,更易溶于强极性的水,而乙醇乙醚有机溶剂的极性介于水和非极性溶剂(如苯)之间,对强极性化合物的溶解能力较弱。
乙醇分子仅能通过较弱的范德华力和有限的氢键与氨基酸作用,乙醇分子中非极性碳链部分会阻碍其与氨基酸极性基团的有效相互作用,这些导致难以克服氨基酸分子间的强离子键和氢键网络。
三、分子间作用力的差异
氨基酸分子间的强相互作用:固态或液态中的氨基酸分子通过离子键、氢键紧密结合,这些作用力需要极性极强的溶剂(如水)才能破坏。乙醇的氢键供体/受体能力较弱,且无法有效屏蔽离子电荷,难以拆散氨基酸分子的聚集。
乙醇与氨基酸的弱相互作用:乙醇仅能通过羟基与氨基酸的极性基团形成有限的氢键,且非极性碳链与氨基酸的离子基团存在排斥阻碍,导致整体相互作用能不足以克服氨基酸分子间的吸引力。
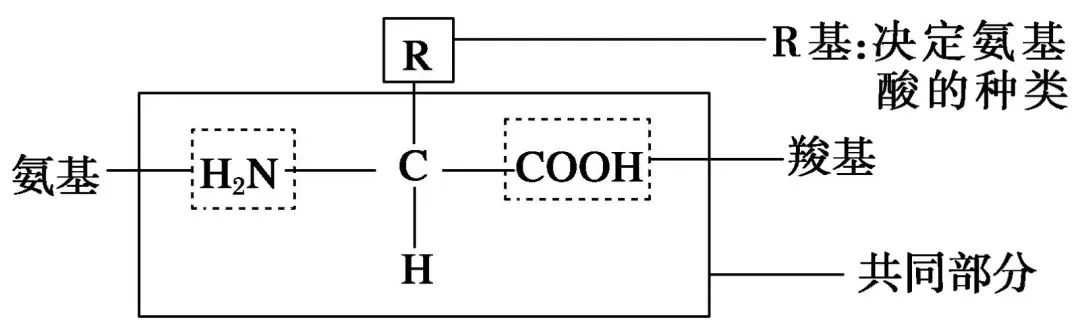
四、特例简析:疏水性氨基酸的有限溶解
侧链疏水性较强的氨基酸(如丙氨酸、亮氨酸),在乙醇中的溶解度可能略高于亲水性氨基酸(如赖氨酸、天冬氨酸),但仍远低于在水中的溶解度。这是因为疏水性侧链可与乙醇的碳链部分产生弱的范德华作用,但极性的氨基和羧基仍受限于乙醇的极性不足,整体溶解能力仍较低。
侧链疏水性氨基酸(如苯丙氨酸、亮氨酸)的侧链为烃基,虽能部分溶于乙醇,但其两性离子主链的强极性仍主导整体溶解性,导致总体溶解度较低。