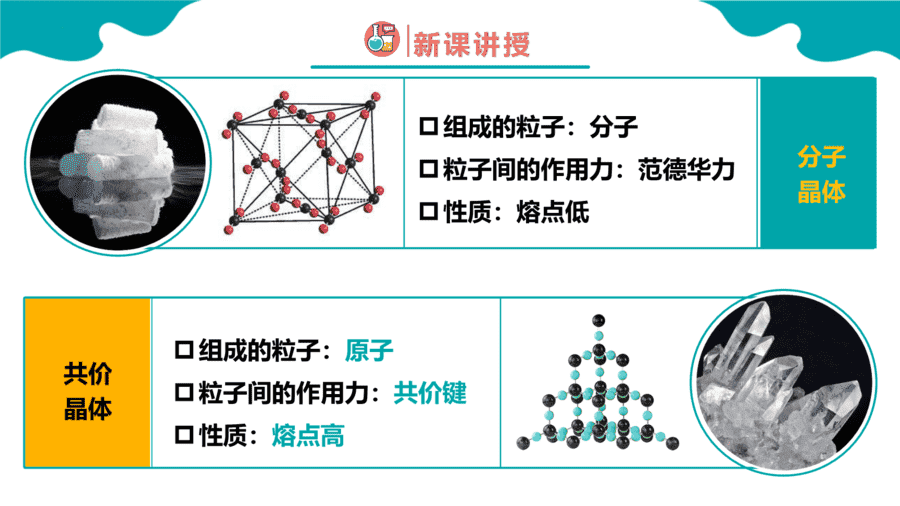
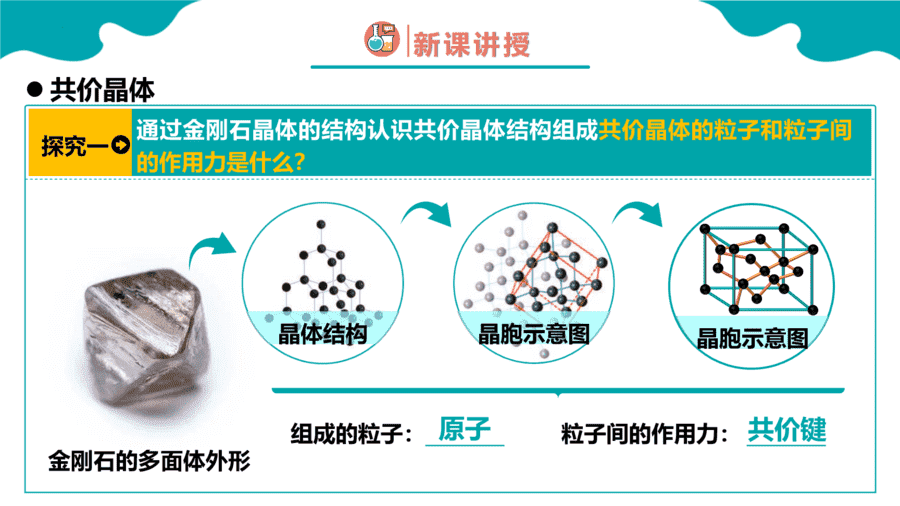
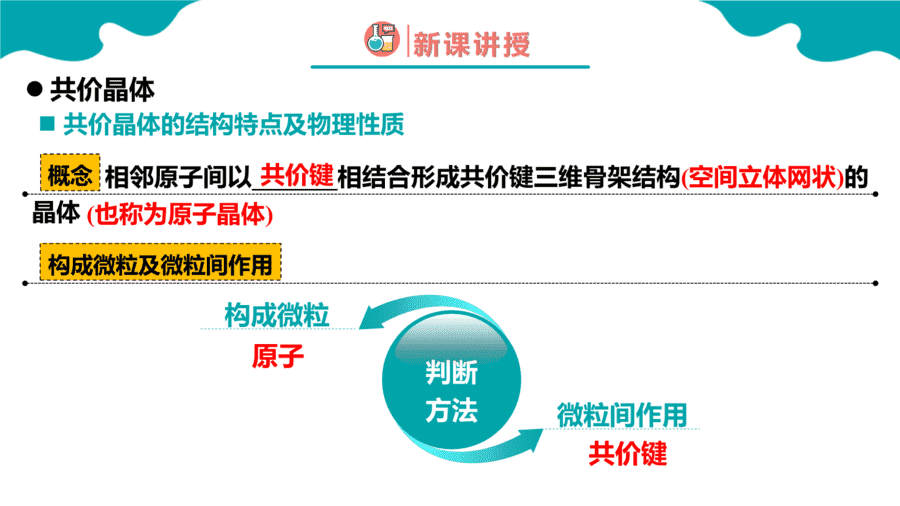
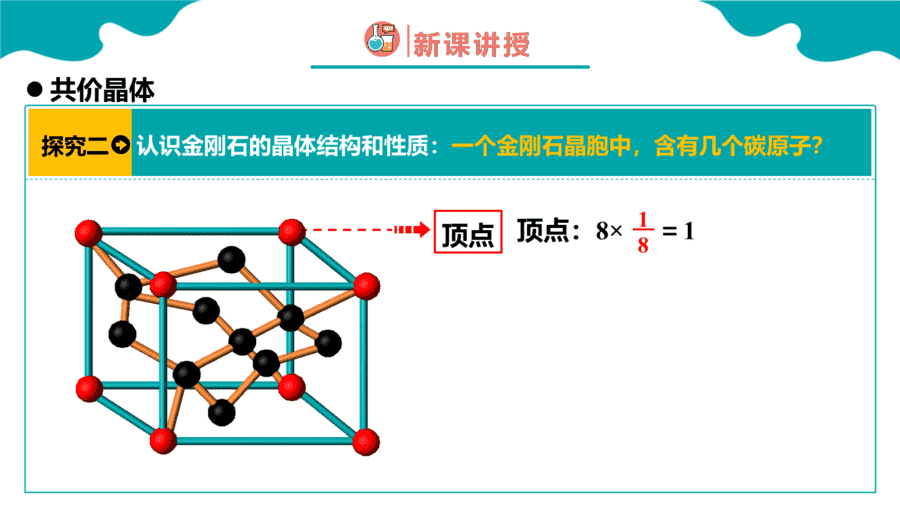
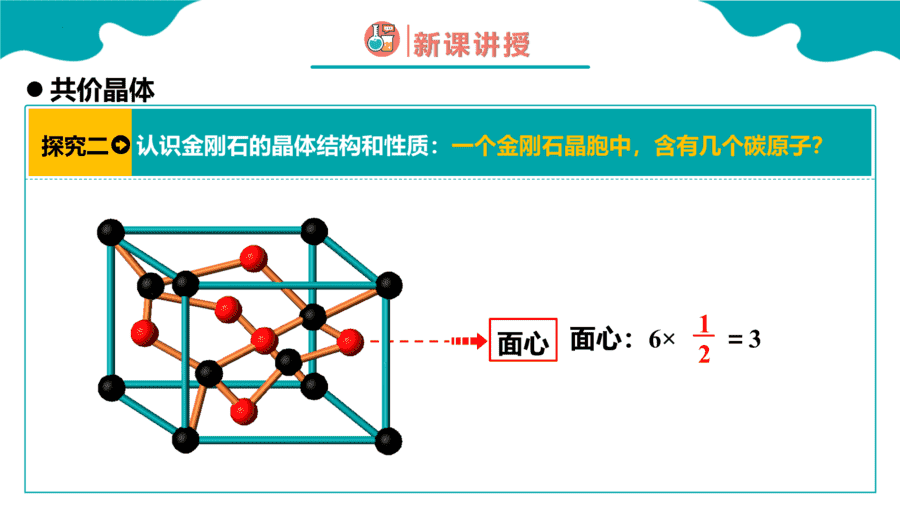
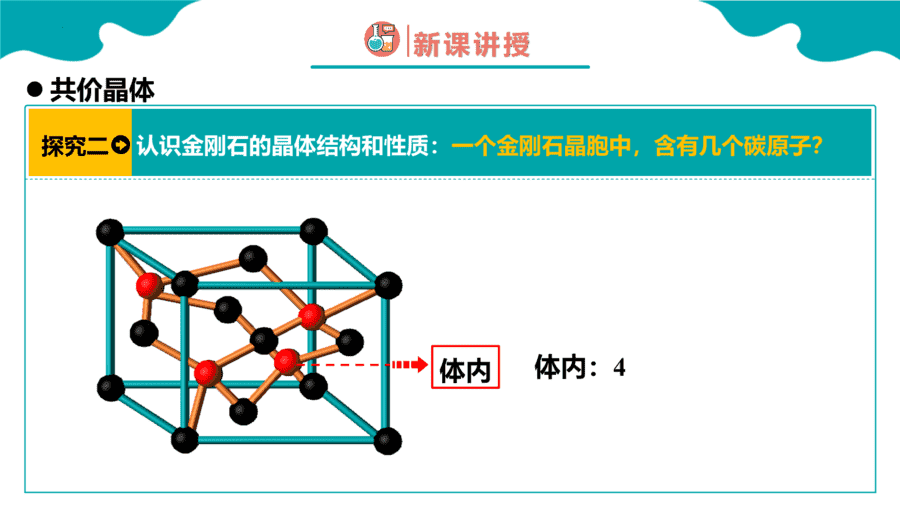
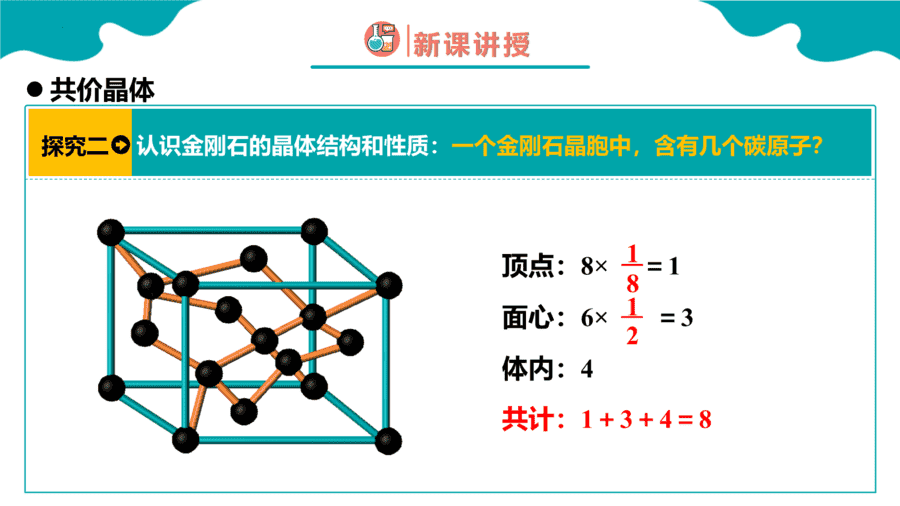
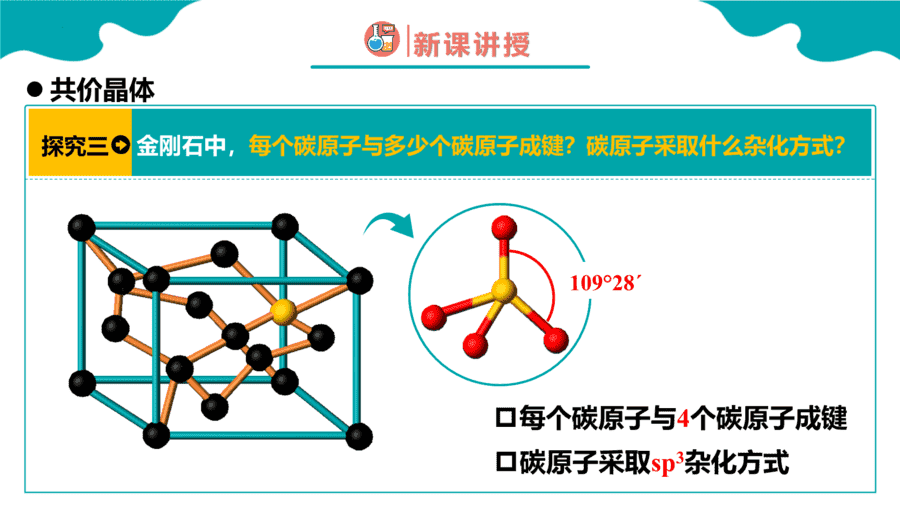
1.下面关于SiO2晶体网状结构的叙述正确的是
A.最小的环上,有3个Si原子和3个O原子
B.最小的环上,Si和O原子数之比为1﹕2
C.最小的环上,有6个Si原子和6个O原子
D.存在四面体结构单元,O处于中心,Si处于4个顶角
【答案】C
【详解】根据SiO2的晶体空间结构模型可判断每个硅原子与4个氧原子结合形成4个共价键,每个氧原子与2个硅原子结合形成2个共价键,其空间网状结构中存在四面体结构单元,硅原子位于四面体的中心,氧原子位于四面体的4个顶角;金刚石的最小环上有6个碳原子,SiO2的晶体结构可将金刚石晶体结构中的碳原子用硅原子代替,每个Si—Si键中“插入”一个氧原子,所以其最小环上有6个硅原子和6个氧原子,Si、O原子个数比为1∶1,因此选项ABD均是错误的,C正确;答案选C。
2.金刚石和石墨的物理性质存在着较大差异,原因是( )
A.它们是由不同种元素构成的 B.他们各自的原子排列方式不同
C.它们具有不同的几何外形 D.石墨能导电而金刚石不能
【答案】B
【详解】物质的组成和结构决定了物质的性质,金刚石和石墨均由C元素构成,但由于结构中碳原子的排列方式不同,所以物理性质存在较大差异,故答案为B。
3.美国《科学》杂志曾报道:在40GPa的高压下,用激光加热到1800K,人们成功制得了共价晶体CO2,下列对该物质的推断一定不正确的是
A.该共价晶体中含有极性键
B.该共价晶体易汽化,可用作制冷材料
C.该共价晶体有很高的熔沸点
D.该共价晶体的硬度大,可用作耐磨材料